中检院发文:肠-肝类器官串联共培养研究药物吸收和毒性过程
为了弥补动物模型的局限性,提出了新的药物安全性评估模型,以完善和减少现有的模型。为了在体外肠-肝脏的微生理系统(MPS)中模拟药物的吸收和代谢,并预测药代动力学和毒性效应,中国食品药品检定研究院安全评价研究所(国家药物安全评价监测中心),中国医学科学院 & 北京协和医学院,德国TissUse GmbH公司的科学家一起合作,建立了一个肠-肝脏串联培养芯片,检测了APAP(对乙酰氨基酚)过量后的急性肝脏损伤过程,并于2024年9月发表于《Food and Chemical Toxicology》杂志。
使用 Caco-2 和 HT29-MTX-E12 细胞系建立了肠类器官,同时利用 HepG2、HUVEC-T1 和经 PMA 诱导的 THP-1 以及人类肝脏星状细胞建立了肝脏类器官。使用高效液相色谱法测定 APAP 浓度,并使用 Phoenix 软件通过非房室分析法拟合药代动力学参数。肝脏损伤生物标志物天冬氨酸转氨酶和丙氨酸转氨酶的变化,以及肝脏功能标志物白蛋白表明,这两个器官芯片模型在 4 天内的短期培养是稳定的。在给药对乙酰氨基酚(APAP)后,活性氧信号增强,同时线粒体膜电位降低,caspase-3(半胱氨酸天冬氨酸蛋白酶-3)被激活,p53 信号增强,表明 APAP 过量引发了毒性反应。在肠肝脏多器官系统模型中,我们拟合了毒代动力学参数,并模拟了 APAP 过量后的肝脏毒性过程,这将有助于器官芯片在药物毒性检测中的应用。
1. 引言
药物性肝脏损伤(DILI)是药物研发的主要障碍,会导致药物撤市(2021 年;2016 年)。动物模型与人体之间的差异以及日益严格的伦理要求,使得有必要采用新的药物安全性评估模型(2014 年)。这种微生理系统(MPS),也称为“芯片上的器官",是一种通过结合微流控、微制造和三维(3D)细胞培养构建的装置。它能够为动物模型重现生理相关的器官功能。MPS平台是一种微型化的体外生理环境(Shinohara等,2021)。
这使得能够模拟和精确控制化学梯度和生物力学力,以模拟体内环境并响应。预定义的微流控通道充当工程化的血管,重现体内生理组织功能(Low 等,2020 年),并允许与其他多器官系统联合(Kulthong 等,2020 年)。此外,多器官系统能够实现实时组织功能监测(Milani 等,2022 年)。
由微流道串联的多器官芯片模型能够进一步模拟人类动态反应和内部器官相互作用(Arakawa 等,2020 年),并为药物暴露与药物效果/毒性的关系提供辅助证据。肠和肝脏是主要的吸收、分布、代谢和排泄(ADME)器官,因此在药代动力学(PK)研究中非常重要(Vernetti 等,2017 年)。
口服药物通过消化道和肠直接吸收进入血液,影响药物的生物利用度和全身剂量。肠芯片模型可以模拟药物吸收,并描绘药物的 ADME 和血药浓度(Milani 等,2022 年)。Lee 等(2017 年)建立了一个三维肠肝脏芯片来描绘对乙酰氨基酚(APAP)的药代动力学模型,而 Arakawa 等(2020 年)构建了一个肠-肝脏模型,用于SAN唑仑的连续代谢的体外定量推算。Milani 等(2022 年)评估了由于肠和肝脏对麦考酚酯代谢而产生的药物前体麦考酚酯的量。因此,类似的方法可以应用于其他多器官的 MPS,以研究人体内的药效学过程。
目前仅有少数关于同时进行毒性检测和样本鉴定的多器官芯片系统的例子被报道。Liu等(2020 年)基于基于肠、血管、肝脏和肾脏芯片的多器官芯片系统研究了人参皂苷复合物 K 的吸收、代谢和毒性。Jeon等(2021 年)报道了一种肠肝脏芯片,重现了脂肪酸的吸收以及随后在肝脏中的脂质积累。
为了探索体外肠-肝脏的微生理系统,在此,我们通过将肠培养物与使用四种细胞系构建的 3D 肝脏球体串联在二联器官芯片(2OC)上,开发了一种可重复的肠-肝脏的二联器官芯片。我们通过检测功能生物标志物和蛋白质的水平来剖析芯片功能,然后在芯片中通过向肠腔室添加肝脏毒性化合物对乙酰氨基酚(APAP)来测试肝脏毒性,以模拟药物吸收后的肝脏毒性。经过 48 小时的孵育,检测了两个腔室中的药物分布和肝脏毒性信号。
2. 材料和方法
2.1. 细胞与培养 细胞资源及培养方法见补充信息。
2.2. 肠的培养
为了在 Transwell 培养板上构建肠模型,以 1 ×10-6 细胞/孔的密度将 Caco-2 细胞接种到 Transwell 培养板(默克公司,PIHP01250)中。将 Caco-2 和 HT29-MTX-E12 细胞以 9:1 的比例混合,并以相同的浓度接种到每个培养板中。从第 0 天到第 7 天,每两天更换一次培养基,第 7 天之后每天更换一次。
2.3. 3D(肝脏)的培养
基于我们之前的研究(Sun 等,2024 年),THP-1 细胞在 RPMI 1640 培养基中稀释至 5 ×10-5 细胞/毫升,然后用 25 纳摩尔的佛波酯酰基乙酸(PMA,MedChemExpress)处理 48 小时,在 6 孔板中进行。随后在培养基中培养 24 小时并用 TryplE(Gibco)进行筛选,经 PMA 诱导的 THP-1 细胞被收集。 2 HepG2、人脐静脉内皮细胞 T1、THP-1 以及人类肝脏星状细胞(HHSC)消化后收集,细胞悬液以 60:19:15:6 的比例混合。为了形成等量细胞,稀释后每孔接种 100 个细胞到圆底 U 型低贴壁 96 孔板(深圳肝脏生物技术有限公司,LV-ULA002-96UW)中。每两天更换一半培养基。 使用高内涵细胞成像分析仪(珀金埃尔默公司,Opretta 系列)对球形形态进行了观察和测量。
2.4. 基于芯片的肠-肝脏共培养
HUMIMIC Chip2 24 孔板(德国 TissUse GmbH)是按照推荐方案(Wagner 等,2013 年)制备的。在肠模型建立后的第 14 天,将 Transwell 细胞嵌体添加到 24 孔培养室中,并将 50 个球体添加到 96 孔培养室中,以形成肠-肝脏芯片模型。
根据之前的方法(Lin 等,2020 年),在2OC 微流道循环中,使用600 ul循环培养基和 400 ul位于屏障顶部的培养基中进行共培养。
肝脏腔室中的培养基每天更换一次,并且收集并更换一半的循环上清液。在 7 天共培养结束时,使用免疫荧光法分析肝脏的器官特异性功能标志物。将片上微流泵设置为 0.8 Hz的频率。
2.5. 肠类器官的完整性
在不同时间点测量荧光素钠和 40 kDa荧光异硫氰酸荧光素 - 葡聚糖的跨内皮电阻(TEER)和肠表观通透性系数(Papp),以评估肠类器官的完整性。方法见补充信息。
2.6. 肝脏类器官的性能评估
在肝脏模型中,选择了一种灵敏的双色荧光细胞活力测定法来区分活细胞和死细胞。使用钙黄绿荧光素 AM(一种细胞可渗透染料)作为活细胞指示物,使用碘化 BOBO-3(Invitrogen 公司)作为死细胞指示物。活细胞成分在活细胞中产生强烈、均匀的绿色荧光(激发/发射 488 纳米/515 纳米),而死细胞成分主要产生细胞核红色荧光(激发/发射 570 纳米/602 纳米)。 在使用建立的肝脏器官芯片模型获得的上清液中测量了各种生物标志物。我们评估了白蛋白(ALB)、尿素(UREA)、天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)的水平,这些是肝脏代谢和损伤的指标。根据制造商的说明,使用 Cell Titor Glo 3D(Promega)测量了三磷酸腺苷(ATP)的含量。 胆酰基-赖氨酸-荧光素(CLF)是一种荧光素标记的胆汁酸,其生物学行为与天然胆酰基甘氨酸非常相似。为了在三维肝脏模型中可视化胆管,我们制备了 20 微摩尔的 CLF 储备液,并将模型在 37°C 下孵育 2 小时。用 Hoechst 33342 染色并孵育 10 分钟。细胞用无酚红培养基冲洗三次,并在激发/发射波长为 498/517 纳米处检测荧光信号。
2.7. 形态学与免疫染色
如前所述(Sun 等,2024 年),肠和肝脏的等量切片用多聚甲醛固定,并用蔗糖溶液脱水。冷冻切片在染色前先用苏木精-伊红(HE)染色、高碘酸-希夫(PAS)染色或免疫染色进行切割。对于免疫染色,切片先用 PBS 冲洗三次 用含有 0.5% Triton X-100(索尔博)的 PBS 处理细胞,处理时间及穿孔处理 10 分钟,用山羊血清(Beyotime Biotechnology)封闭 30 分钟,在室温下进行。按照说明书以一定稀释度向每个孔中加入一抗原位体,并在 4℃下孵育过夜。使用以下一抗原位体:抗 Occludin(91131S,CST,1:400 稀释度)、抗 ZO-1(ab221547,Abcam,1:100 稀释度)、抗 MRP2(ab172630,Abcam,1:500 稀释度)和抗 PGP(货号 25081-2-AP,ProteinTech,1:500 稀释度)。清洗细胞,用相应的荧光偶联二抗原位体处理,并与 DAPI(Beyotime Biotechnology)共定位。使用高内涵细胞成像分析仪或显微镜(奥林巴斯 IX71)观察明视野形态和切片。 对于原位免疫荧光染色,肠膜和 3D 肝脏模型用 PBS 冲洗三次,并用 4%多聚甲醛固定 30 分钟。接下来,样本在含有 0.5% Triton X-100(索尔博)的 PBS 中穿孔处理 10 分钟,并在室温下用山羊血清(Beyotime Biotechnology)封闭 30 分钟。 按照说明书,将稀释后的原位抗体以一定稀释度加入每个孔中,并在4℃下孵育过夜。使用的原位抗体包括:抗Occludin(91131S,CST,1:400稀释)、抗ZO-1(sc-33725,Santa Cruz Biotechnology,1:500稀释)、抗MRP2(ab172630,Abcam,1:500稀释)、抗ABCB11/BSEP(ab255605,Abcam,1:100稀释)、抗PGP(Cat No. 25081-2-AP,ProteinTech,1:500稀释)、抗CYP3A4(MA5-17064,ThermoFisher,1:1000稀释)、抗Ki67(9449S,CST,1:10,000稀释)、抗CD31(3528S,CST,1:100稀释)、抗CD68(ab213363,Abcam,1:100稀释)、抗SMA(14395-1-AP,ProteinTech,1:100稀释)、抗裂解的caspase-3(9664S,CST,1:400稀释)和抗p53(2524S,CST,1:2000稀释)。细胞经过洗涤,与荧光偶联的次级抗体孵育,并与DAPI(Beyotime Biotechnology)共定位。使用的次级抗体包括:山羊抗兔IgG H&L(Alexa Fluor® 488)(ab150077,Abcam,1:1,000稀释)、山羊抗鼠IgG(H + L)(Alexa Fluor® 555 Conjugate)(4417,CST,1:1000稀释)和山羊抗小鼠IgG H&L(Alexa Fluor® 488)(ab150113,Abcam,1:1,000稀释)。结果通过高含量分析和荧光显微镜进行评估。
2.8. 药物毒性和细胞活力测定
如前所述(Sun 等,2024 年),使用 Cell Titor Glo 检测细胞活力,并测定细胞存活率和细胞存活率(%)。在 96 孔板中,以 1 ×10-4细胞/孔的密度将细胞接种到 96 孔板中;次日丢弃上清液,并与对乙酰氨基酚(4 毫摩尔)一起培养。使用同样的方法测定球体的存活率。该检测使用光度计进行。
2.9. 阿司匹林在共培养芯片中的模拟口服过程
加载了 7 个 2OC 模型,其中 4 个微流道给药对乙酰氨基酚(APAP),其余回路未给予。为了模拟口服过程以及 APAP 诱导的肝脏毒性后果,在加载 2OC 回路后的第二天,向插入物顶部加入 400 微升 10 毫摩尔的 APAP。在 0、0.5、1、2、4、8、24、32 和 48 小时分别收集 10 微升上清液用于液相色谱定量分析。在给药 48 小时后,收集上清液用于各种生物标志物的测量以评估透皮电阻(TEER)。同时收集肝脏球体用于肝脏毒性评估。我们还至少收集了 3 - 5 个用于细胞活力测定,其余部分转移到 96 孔板中保存以用于荧光染色。
2.10. 共培养芯片的肝脏毒性评估
根据推荐的试剂盒方案,测量细胞活力以及白蛋白(ALB)、天冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)水平,以评估药物给药 48 小时后的肝脏损伤情况。使用线粒体膜电位检测试剂盒(Beyotime Biotechnology,C2001S)进行测定线粒体膜电位。将 2OC 芯片的 3D 包埋肝脏模型转移到 96 孔板中。分别在 Ex/Em = 550/575 和 350/461 纳米检测四甲基罗丹明乙酯(TMRE)和 Hoechst 33342 的荧光信号。使用 CellROX 氧化应激试剂(赛默飞世尔科技,C10444)测定氧化应激。 将 2OC 芯片的 3D 嵌入式肝脏模型转移到 96 孔板中。分别在 485/520 纳米和 350/461 纳米检测 CellROX 和 Hoechst 33342 的荧光信号。使用免疫荧光染色法检测原位 Ki-67、裂解的 caspase-3 和 p53 信号,以评估细胞增殖能力和细胞凋亡情况。
2.11. 样本定量
基于之前的方法(Marin 等,2019 年),使用高效液相色谱法(HPLC)(岛津,LC-2040C 3D)测量对乙酰氨基酚(APAP)的浓度。基底侧腔室(肝脏腔室)用新鲜培养基填充,而顶侧腔室暴露在对乙酰氨基酚培养基中。在每个时间点,如第 2.9 节所述,从两侧各取 10 微升样本。选择甲醇作为蛋白质沉淀剂,在加入 30 微升甲醇以沉淀蛋白质后,通过离心机(13000 转/分钟,4℃,15 分钟)去除沉淀物。使用惰性可持续 C18(150 毫米长度,内径 4.6 毫米,粒径 5 微米,岛津)色谱柱。使用两种流动相:溶剂 A(甲醇)和溶剂 B(蒸馏水),流速为 0.8 毫升/分钟。溶剂组成在 0 - 4 分钟为 5% A,4.01 - 10 分钟为 5 - 100% A,10.01 - 15 分钟为 5% A。进样量为 10 微升,检测使用光电二极管阵列(PDA)检测器(波长 280 纳米)。使用标准曲线测定对乙酰氨基酚的浓度。 药代动力学参数使用非房室模型(NCA)在 Phoenix WinNonlin(Certara,美国)中进行拟合。采用线性梯形线性插值法作为计算方法,模型类型定义为血浆,剂量选项定义为血管外。通过高效液相色谱法测定的肝脏隔室中的对乙酰氨基酚(APAP)浓度 - 时间数据进行拟合,以确定 0 至 48 小时下的曲线下面积(AUC)。峰值浓度(Cmax)和达峰时间(Tmax)直接从个体浓度与时间曲线中读取(高等,2022 年;王等,2022 年)。 采用超高效液相色谱 - 串联质谱法(UPLC-MS)检测 NAPQI 的信号(张等,2018 年)。通过将 N-乙酰基对苯二酚亚胺(NAPQI)(MCE,HY-66005)溶解在甲醇中制备浓度为 1 毫克/毫升的储备溶液,并用甲醇进一步稀释至 1 微克/毫升的工作溶液。对 NAPQI 的形成进行了分析。 在服用对乙酰氨基酚(APAP)后 0.5、1、2、4、8、24、32 和 48 小时,使用配备 AB SCIEX LC AC 系统、PDA 检测器和三重四极杆 6600+仪器的超高效液相色谱 - 质谱法(UPLC-MS)进行检测。通过使用沃特斯 ACQUITY UPLC BEH C18 色谱柱(2.1 毫米×50 毫米)实现了色谱分离。 1.7 微米)。使用的洗脱液为(A)0.1%(体积比)的甲酸水溶液和(B)甲醇,采用梯度洗脱程序进行分离,如表S1所示。超高效液相色谱流速为0.3 mL/min,超高效液相色谱-质谱分析使用10 微升样品。对应于解聚电位、碰撞能量、碰撞能量分布和温度的离子对特征为m/z 149.98-108.04(30、30、15和350),对应于NAPQI。
2.12. 统计分析
连续变量以均值±偏差(标准差)表示。采用双尾学生 t 检验来研究两个独立样本之间的差异。数据分析使用 IBM SPSS Statistics 25 版(IBM 公司)进行。线性回归模型使用 SPSS 和 GraphPad Prism 7.00(GraphPad 软件)进行。统计学意义设定为 P≤0.05。
3. 结果
3.1. 类器官的培养
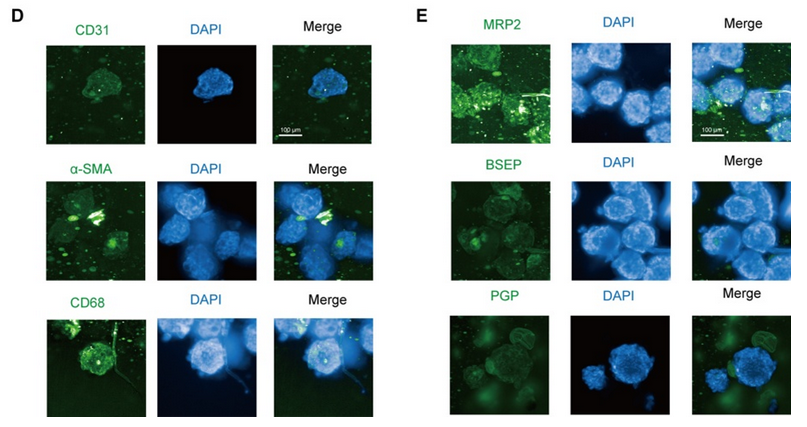
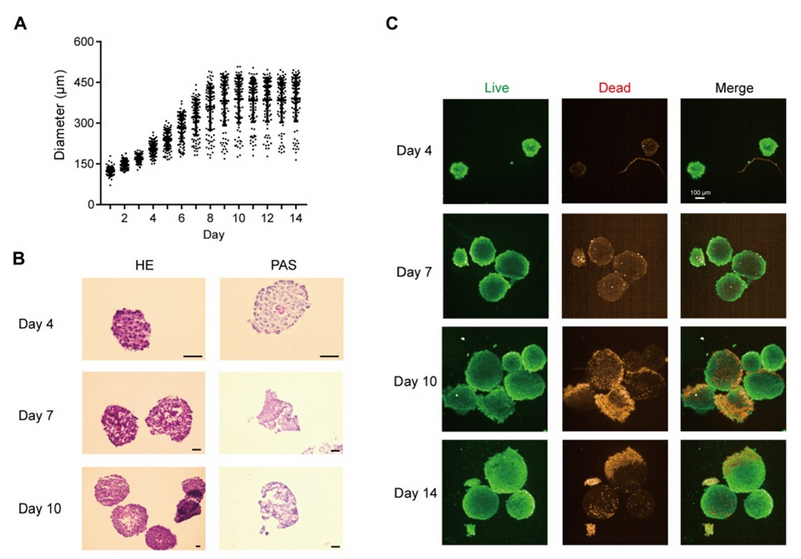
将细胞混合物以 1 ×10-6、5 ×10-5 和 2.5 ×10-5 个细胞/孔的密度接种到 Transwell 培养板中,以获得体外肠模型。所有组的跨上皮电阻(TEER)在 21 天内均达到 300 Ω cm2,其中高密度共培养组在 12 天内达到 300 Ω cm2(图 1A)。在第 14 天,高密度共培养组模型中荧光素钠和荧光素葡聚糖均符合渗透性测试要求(图 1B)。当跨上皮电阻达到 200 - 1000 Ω cm2 时,Caco - 2 单层可被视为完整(Iftikhar 等,2020 年)。在后续实验中,选择高密度共培养组来形成肠屏障。 紧密连接蛋白 Occludin 和 ZO-1 经过染色,以显示其在肠等值物培养条件下的完整性。在第 7 天和第 21 天,我们观察到 Occludin 的连续网络结构(图 1C),而在第 14 天和第 21 天的切片中,Occludin 和 ZO-1 呈网状结构(图 1D,图 S1A),表明在第 14 天肠屏障被视为完整的。在第 14 天和第 21 天,转运蛋白 MRP2 和 PGP 分布在肠切片的一侧(图 1E,图 S1B),表明肠模型的极性。总体而言,结果表明在第 14 天获得的肠等值物具有紧密连接和极性;因此,在第 14 天肠屏障被视为成熟的,并用于进一步的实验。 在图 2A 中,模型的直径在 10 天内迅速增大,并稳定在约 400 微米。HE 染色显示在第 7 天(图 2B)没有明显的坏死核心,但在第 10 天(图 2B)有轻度坏死核心或几个细胞凋亡,在第 14 天(图 S1I)有严重的中心坏死区域。与活/死细胞染色(图 2C)所示的死细胞分布一致,在第 10 天检测到更多的死细胞。模型中 ATP 的总量持续增加(图 S1C),而乳酸脱氢酶(LDH)的分泌没有显著增加(图 S1D)。模型稳定生长,随着培养时间的延长,坏死细胞数量增加,通过检测上清液中的 LDH 水平无法检测到内部坏死细胞。为避免坏死细胞核的形成,这些结果表明培养时间限制为 7 天。 在第 7 天(图 2D)和第 10 天,分别通过 CD31、CD68 和α-SMA 信号来追踪人脐静脉内皮细胞 T1(HUVEC-T1)、人肺泡巨噬细胞 THP-1 和人肝脏星状细胞 HHSC 的荧光信号,采用免疫荧光染色法进行追踪。
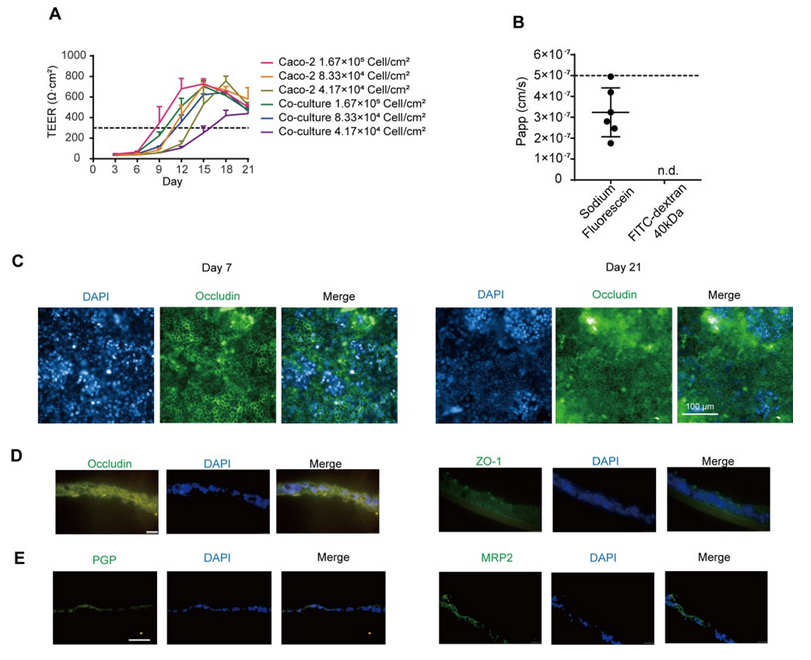
图 S1G 表明,上述三种细胞类型在第 10 天仍存在于球体中。在第 7 天检测了转运蛋白 MRP2、PGP 和 BSEP(图 2E),并通过荧光探针 CLF 追踪了胆汁酸外排的功能(图 S1H)。CLF 是 MRP2 和 BSEP 的底物(Boaglio 等,2010 年),CLF 信号也表明了这些转运蛋白在类器官中的功能。 最后,PAS 染色显示有糖原沉积(图 2B),ALB 和 UREA 的增加趋势表明,即使在细胞死亡紧急情况下,肝脏的总合成代谢功能也未受阻碍(图 S1E - F)。这些结果表明,在 14 天内,类器官对肝脏功能的影响相对稳定。
111