H9N2流感病毒通用疫苗研究取得进展
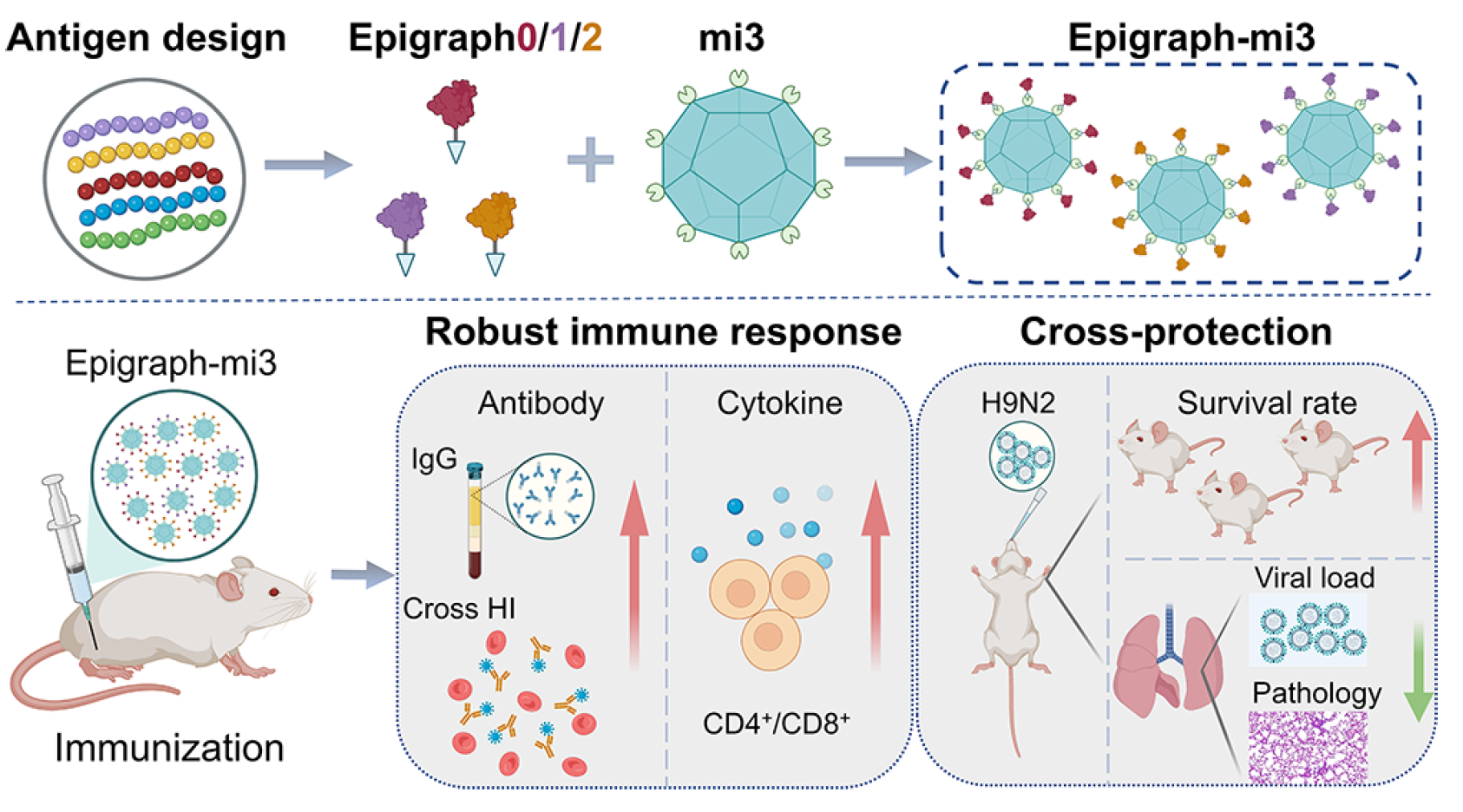
2025年6月份,中国科学院武汉病毒研究所科研团队在《ACS Nano》期刊发表了题为“Epitope-Optimized Influenza Hemagglutinin Nanoparticle Vaccine Provides Broad Cross-Reactive Immunity against H9N2 Influenza Virus"的研究论文。该研究成功开发出一种针对H9N2流感病毒的表位优化型纳米颗粒疫苗,在动物模型中展现出对多种H9N2毒株的广谱交叉免疫保护效力,为全球 H9N2 流感疫情的防控提供了创新性解决方案。
摘要
H9N2病毒(AIV)对全球家禽业构成日益严重的威胁,并持续存在感染人类的风险。疫苗接种是预防和控制H9N2 AIV的关键策略。然而,病毒的持续进化不断挑战免疫保护的效率。因此,开发一种能够引发广谱免疫反应的通用H9N2流感疫苗对于疫情防控至关重要。本研究报道了一种表位优化的纳米颗粒(NPs)疫苗,该疫苗能够引发针对H9N2流感病毒的广泛交叉反应性免疫。利用计算算法Epigraph,我们首先设计了三个具有优化表位的H9血凝素(HA1)球状头部。随后,每个抗原与mi3 NPs结合,并将这三种构建体以等摩尔比例混合,生成Epigraph疫苗。我们将Epigraph疫苗与目前推荐的候选疫苗病毒(CVV)AL/39进行了比较。Epigraph疫苗在小鼠中有效诱导了交叉反应性抗体,并激活了CD4+和CD8+ T细胞免疫反应。此外,该疫苗对多种H9N2毒株的致死性攻击提供了有效保护,并显著降低了小鼠肺部的病毒载量。本研究为应对未来H9N2疫情提供了一种有前景的通用疫苗候选方案。
介绍
H9N2亚型病毒(AIV)于1966年从美国威斯康星州的火鸡中分离,现已在欧亚大陆、中东和非洲国家的多种家禽中形成地方性流行,对全球家禽业造成严重经济损失,并在哺乳动物和人类中引发零星感染。自1994年在中国分离以来,经过20多年的传播与进化,H9N2已取代H7N9和H5N6病毒,成为中国禽类中的主要AIV亚型。目前,H9N2无需适应性突变即可直接感染人类,引发不同程度的呼吸道疾病。自1998年报告人类感染H9N2病例以来,2014年至2016年间,中国部分省份职业暴露人群的H9N2 AIV血清阳性率已达11.20%,表明禽类从业人员感染H9N2的风险显著增加。
此外,自2020年以来,人类感染H9N2的病例数量显著上升。截至目前,已有超过150人感染H9N2 AIV。系统发育分析表明,H9N2病毒是人类H5N1、H7N9、H3N8和H10N8病毒内部基因的供体,凸显了其在新型流感病毒株出现中的关键作用。
近期研究表明,大多数H9N2病毒已获得与人类型受体(α2,6唾液酸)结合的能力,这凸显了采取有效措施预防和控制H9N2传播的紧迫性。开发针对潜在大流行亚型的疫苗是大流行防控的关键策略。迄今为止,已开发出多种H9N2候选疫苗。然而,中国的H9N2病毒经历了广泛的基因重配,导致新基因型的不断出现。这种持续的抗原变异显著促进了病毒在免疫禽类中的传播。尽管市售H9N2疫苗对匹配抗原的毒株普遍有效,但其对不匹配抗原毒株的保护效力有限。例如,1997年至2002年间分离的大多数H9N病毒与代表性疫苗株SD/6/96相比,表现出抗原漂移。疫苗株与流行株之间的不匹配使得有效控制H9N2病毒的传播更加复杂,凸显了改进疫苗技术并产生针对多种H9N2流感病毒的广泛交叉免疫的迫切需求。
Epigraph是一种高效的基于图的算法,通过所有潜在9聚体T细胞表位的覆盖范围来设计疫苗抗原。该算法已应用于开发治疗性HIV疫苗候选物和泛丝状病毒疫苗候选物。在小鼠和猪模型中,使用Epigraph算法设计的流感病毒候选疫苗表现出优于市售全灭活四价猪流感疫苗的交叉免疫反应。使用Epigraph算法设计的腺病毒载体疫苗已显示出对猪H3亚型流感病毒的强保护性免疫反应。此外,计算设计的多价Epigraph血凝素疫苗在小鼠模型中表现出对乙型流感病毒的保护效力。该算法能够高效计算设计单抗原或多抗原疫苗,病原体群体的潜在表位覆盖范围,并适用于包括疫苗开发在内的抗原设计项目。
血凝素(HA)蛋白是流感病毒表面暴露的糖蛋白,是自然和疫苗介导的甲型流感病毒免疫中免疫原性的靶点。HA通过结合细胞表面受体并诱导膜融合启动感染,同时也是抗流感药物的主要靶点。位于HA蛋白球状头部的受体结合域已被确定为疫苗接种后引发有效中和抗体的关键。尽管在开发基于HA的疫苗方面做出了诸多努力,但亚单位疫苗的低免疫原性仍然是一个限制因素。为克服这一限制,已使用多种类型的纳米颗粒(NPs)通过多价抗原呈递增强流感亚单位疫苗的免疫原性,包括病毒样颗粒(VLPs)、噬菌体、多糖和病毒体。例如,计算设计并优化的突变体i3−01(mi3)已被用作纳米级支架以增强抗原免疫原性。
抗原与纳米颗粒的偶联可通过自发连接的SpyTag-SpyCatcher蛋白质共价键合策略实现。该系统展现出显著的连接效率和稳定性。在本研究中,我们将三个表位优化的HA1蛋白通过SpyTag共价连接到经SpyCatcher修饰的纳米颗粒上,使目标蛋白能够轻松附着于纳米颗粒表面。通过将三种纳米颗粒混合,我们设计了一种Epigraph疫苗候选物。动物实验表明,该Epigraph疫苗能够诱导高效且广泛的体液和细胞免疫反应,并对不同H9N2病毒株的致死性攻击提供充分保护。本研究支持Epigraph疫苗作为通用型H9N2流感疫苗的潜在候选物。
近期研究表明,大多数H9N2病毒已获得与人类型受体(α2,6唾液酸)结合的能力,这凸显了采取有效措施预防和控制H9N2传播的紧迫性。开发针对潜在大流行亚型的疫苗是大流行防控的关键策略。迄今为止,已开发出多种H9N2候选疫苗。然而,中国的H9N2病毒经历了广泛的基因重配,导致新基因型的不断出现。这种持续的抗原变异显著促进了病毒在免疫禽类中的传播。尽管市售H9N2疫苗对匹配抗原的毒株普遍有效,但其对不匹配抗原毒株的保护效力有限。例如,1997年至2002年间分离的大多数H9N2病毒与代表性疫苗株SD/6/96相比,表现出抗原漂移。疫苗株与流行株之间的不匹配使得有效控制H9N2病毒的传播更加复杂,凸显了改进疫苗技术并产生针对多种H9N2流感病毒的广泛交叉免疫的迫切需求。
Epigraph是一种高效的基于图的算法,通过所有潜在9聚体T细胞表位的覆盖范围来设计疫苗抗原。该算法已应用于开发治疗性HIV疫苗候选物和泛丝状病毒疫苗候选物。在小鼠和猪模型中,使用Epigraph算法设计的流感病毒候选疫苗表现出优于市售全灭活四价猪流感疫苗的交叉免疫反应。使用Epigraph算法设计的腺病毒载体疫苗已显示出对猪H3亚型流感病毒的强保护性免疫反应。此外,计算设计的多价Epigraph血凝素疫苗在小鼠模型中表现出对乙型流感病毒的保护效力。该算法能够高效计算设计单抗原或多抗原疫苗,不同病原体群体的潜在表位覆盖范围,并适用于包括疫苗开发在内的抗原设计项目。
血凝素(HA)蛋白是流感病毒表面暴露的糖蛋白,是自然和疫苗介导的甲型流感病毒免疫中免疫原性的靶点。HA通过结合细胞表面受体并诱导膜融合启动感染,同时也是抗流感药物的主要靶点。位于HA蛋白球状头部的受体结合域已被确定为疫苗接种后引发有效中和抗体的关键。尽管在开发基于HA的疫苗方面做出了诸多努力,但亚单位疫苗的低免疫原性仍然是一个限制因素。为克服这一限制,已使用多种类型的纳米颗粒(NPs)通过多价抗原呈递增强流感亚单位疫苗的免疫原性,包括病毒样颗粒(VLPs)、噬菌体、多糖和病毒体。例如,计算设计并优化的突变体i3−01(mi3)已被用作纳米级支架以增强抗原免疫原性。
抗原与纳米颗粒的偶联可通过自发连接的SpyTag-SpyCatcher蛋白质共价键合策略实现。该系统展现出显著的连接效率和稳定性。在本研究中,我们将三个表位优化的HA1蛋白通过SpyTag共价连接到经SpyCatcher修饰的纳米颗粒上,使目标蛋白能够轻松附着于纳米颗粒表面。通过将三种纳米颗粒混合,我们设计了一种Epigraph疫苗候选物。动物实验表明,该Epigraph疫苗能够诱导高效且广泛的体液和细胞免疫反应,并对不同H9N2病毒株的致死性攻击提供充分保护。本研究支持Epigraph疫苗作为通用型H9N2流感疫苗的潜在候选物。
结果
H9表位抗原的设计与开发
H9表位抗原是使用Epigraph疫苗在线设计工具进行设计的,该工具采用了一种高效的基于图的算法,通过将每个连续的抗原表位长度片段(即每个k-mer)视为潜在抗原表位,从而病原体群体的潜在表位覆盖范围。通常,k=9被设定为潜在T细胞表位(PTE)的长度,因为这是大多数细胞毒性T细胞I类表位的最佳长度。在抗原设计之前,我们从GISAID下载了截至2022年11月的所有可用H9N2 HA1序列。设计过程首先将数据集中的每个序列分解为所有可能的9-mer,并计算每个9-mer在样本群体中的频率值(覆盖分数)。随后,该算法从具有最高覆盖分数的短序列(9-mer)中组装出一组代表性蛋白序列(Epigraph0),确保该序列包含目标病毒群体中最常见的潜在9-mer表位。对于单价疫苗,单一抗原已足够。然而,为了进一步提高覆盖范围,该算法去除由Epigraph0覆盖的表位,并生成第二个互补序列(Epigraph1)。此过程重复进行以生成第三个互补序列(Epigraph2)。Epigraph0代表的单一抗原,Epigraph1是最佳互补抗原,依此类推。虽然增加Epigraph序列的数量可以提高群体覆盖范围,但随着越来越罕见的表位被纳入,收益逐渐递减。最终的三价Epigraph免疫原(由Epigraph0、Epigraph1和Epigraph2抗原混合而成)为群体中的潜在线性表位提供了覆盖。
为了可视化三个Epigraph序列与整个群体之间的关系,我们使用MAFFT将序列与来自流感研究数据库的6,445个H9 HA1蛋白序列进行比对,并构建了最大似然(ML)系统发育树(图1A)。通过BLAST比对,我们在数据库中识别出最相似的野生型序列如下:Epigraph0-A/鸡/北京/XY1125/2014(序列一致性:99.7%),Epigraph1-A/鸡/安徽/A3176/2014(序列一致性:90.21%),以及Epigraph2-A/鸡/大阪/aq69/2001(序列一致性:90%)。为了评估Epigraph疫苗的效力,我们将其与当前推荐的候选疫苗病毒(CVV)A/安徽-庐江/39/2018(AL/39,2018年的人类分离株)进行了比较,该疫苗是世界卫生组织(WHO)于2018年推荐的候选灭活疫苗。
Production and Characterization of H9 Epigraph-mi3NPs
TH9 Epigraph-mi3纳米颗粒的制备与表征。纳米颗粒的尺寸对于激发免疫反应至关重要,其必须与病原体尺寸相当,才能被免疫细胞有效识别。因此,它们可作为载体,将抗原高效递送至抗原呈递细胞(APC),并诱导最佳的免疫激活反应。本研究采用mi3纳米颗粒作为抗原展示的纳米级支架,以提升免疫系统的激活效率。该支架是一种自组装的多孔十二面体结构,由60个相同亚基构成,作为多聚化纳米颗粒平台,为免疫原性较弱的抗原提供安全且具有免疫原性的疫苗接种系统。
如先前所述,SpyTag是一种13个氨基酸的肽段,可在短时间内与其蛋白伴侣SpyCatcher(92个氨基酸)形成共价键(图1B)。SpyCatcher/SpyTag系统因其简便性、快速性及实现体外蛋白质自组装的能力而被广泛应用于蛋白质偶联。因此,我们将SpyCatcher融合至mi3的N端(图1C)。如图1D、E所示,SpyCatcher-mi3在大肠杆菌细胞质中可溶且高效表达,并通过镍柱亲和层析及尺寸排阻色谱(SEC)进行纯化。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析显示,SpyCatcher-mi3纳米颗粒呈现单一清晰条带,SEC色谱图中观察到单一主峰,表明其结构均一且纯度较高。负染透射电子显微镜(TEM)显示,SpyCatcher-mi3组装成预期的十二面体球形颗粒,直径约为26 nm,略小于动态光散射(DLS)测得的流体力学直径(图1F、G)。为评估mi3纳米颗粒的稳定性,我们进行了SDS-PAGE分析。将mi3纳米颗粒在37、25、4及−80 °C下孵育1周,以评估其潜在降解情况。结果表明,mi3纳米颗粒在所有测试温度下均保持高度稳定(图S1A),符合疫苗生产中纳米颗粒支架的标准。
我们将SpyTag融合至密码子优化的Epigraph HA基因的C端,将其克隆至pCAGGS载体中,并瞬时转染HEK293F细胞,获得Epigraph0-SpyTag、Epigraph1-SpyTag及Epigraph2-SpyTag抗原。SDS-PAGE分析显示,三种Epigraph抗原均呈现单一清晰条带,表明抗原纯度较高(图1D)。稳定性实验表明,Epigraph抗原在37、25、4及−80 °C下孵育1周后仍保持稳定(图S1A)。
我们将SpyTag融合到密码子优化的Epigraph HA基因的C端,将其克隆到pCAGGS载体中,并通过瞬时转染HEK293F细胞获得了Epigraph0-SpyTag、Epigraph1-SpyTag和Epigraph2-SpyTag抗原。SDS-PAGE分析显示,所有三种Epigraph抗原均呈现单一清晰的条带,表明抗原纯度较高(图1D)。稳定性实验表明,Epigraph抗原在37°C、25°C、4°C和−80°C下孵育1周后仍保持稳定(图S1A)。
为制备Epigraph-mi3纳米颗粒(NPs),我们首先评估了SpyCatcher-mi3与Epigraph-SpyTag在不同比例下的结合效率。结果显示,随着Epigraph-SpyTag量的增加,残留的SpyCatcher-mi3逐渐减少。值得注意的是,当SpyCatcher-mi3与Epigraph-SpyTag的摩尔比达到1:4时,SpyCatcher-mi3的减少不再明显,表明支架已达到饱和且存在过量的未结合Epigraph-SpyTag(图S2)。基于这些发现,我们将15 μM的SpyCatcher-mi3与60 μM的Epigraph-SpyTag(mi3 NPs支架与Epigraph抗原的比例为1:4)在4°C下孵育过夜进行体外结合反应,随后通过SEC纯化去除未反应的Epigraph抗原和未结合的mi3 NPs。图1D中的SDS-PAGE结果显示,结合产物Epigraph-mi3呈现单一清晰的条带,明显大于Epigraph抗原和mi3,证实Epigraph抗原已有效结合到mi3 NPs上。这一结果在SEC色谱图中Epigraph-mi3 NPs峰的前移中得到了进一步验证(图1E)。负染TEM显示,mi3 NPs呈现规则形状的球形颗粒,而Epigraph0-mi3 NPs表面模糊,可见明显的突出蛋白,且直径大于mi3 NPs。图1F中Epigraph1-mi3和Epigraph2-mi3 NPs也观察到类似结果。DLS分析证实了颗粒尺寸分布,Epigraph-mi3 NPs的流体动力学直径大于未结合的mi3 NPs(图1G)。
此外,所有 Epigraph-mi3 纳米颗粒的多分散性指数(PDI)值均低于 0.5,表明 Epigraph-mi3 纳米颗粒具有均匀的尺寸分布(表 S1)。
为了探究将 Epigraph 抗原偶联到 mi3 纳米颗粒上是否会影响其热稳定性,我们将 Epigraph-mi3 纳米颗粒分别在 37、25、4 和 -80 °C 下孵育 1 周。结果表明,在 -80 至 25 °C 的测试温度范围内,Epigraph-mi3 纳米颗粒未出现显著降解(图 S1A)。差示扫描荧光法(DSF)结果显示,Epigraph-mi3 纳米颗粒和相应的 Epigraph 抗原表现出相似的热稳定性,具有几乎相同的 Tm 值,这表明 Epigraph 抗原与 mi3 蛋白的融合对其结构稳定性没有显著影响(图 S1B)。由于大多数疫苗建议在冷藏条件下(2 - 8 °C)储存,本研究构建的纳米颗粒疫苗在常规疫苗储存条件下保持了一定程度的热稳定性。
Production and Characterization of H9 Epigraph-mi3NPs
TH9 Epigraph-mi3纳米颗粒的制备与表征。纳米颗粒的尺寸对于激发免疫反应至关重要,其必须与病原体尺寸相当,才能被免疫细胞有效识别。因此,它们可作为载体,将抗原高效递送至抗原呈递细胞(APC),并诱导最佳的免疫激活反应。本研究采用mi3纳米颗粒作为抗原展示的纳米级支架,以提升免疫系统的激活效率。该支架是一种自组装的多孔十二面体结构,由60个相同亚基构成,作为多聚化纳米颗粒平台,为免疫原性较弱的抗原提供安全且具有免疫原性的疫苗接种系统。
如先前所述,SpyTag是一种13个氨基酸的肽段,可在短时间内与其蛋白伴侣SpyCatcher(92个氨基酸)形成共价键(图1B)。SpyCatcher/SpyTag系统因其简便性、快速性及实现体外蛋白质自组装的能力而被广泛应用于蛋白质偶联。因此,我们将SpyCatcher融合至mi3的N端(图1C)。如图1D、E所示,SpyCatcher-mi3在大肠杆菌细胞质中可溶且高效表达,并通过镍柱亲和层析及尺寸排阻色谱(SEC)进行纯化。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析显示,SpyCatcher-mi3纳米颗粒呈现单一清晰条带,SEC色谱图中观察到单一主峰,表明其结构均一且纯度较高。负染透射电子显微镜(TEM)显示,SpyCatcher-mi3组装成预期的十二面体球形颗粒,直径约为26 nm,略小于动态光散射(DLS)测得的流体力学直径(图1F、G)。为评估mi3纳米颗粒的稳定性,我们进行了SDS-PAGE分析。将mi3纳米颗粒在37、25、4及−80 °C下孵育1周,以评估其潜在降解情况。结果表明,mi3纳米颗粒在所有测试温度下均保持高度稳定(图S1A),符合疫苗生产中纳米颗粒支架的标准。
我们将SpyTag融合至密码子优化的Epigraph HA基因的C端,将其克隆至pCAGGS载体中,并瞬时转染HEK293F细胞,获得Epigraph0-SpyTag、Epigraph1-SpyTag及Epigraph2-SpyTag抗原。SDS-PAGE分析显示,三种Epigraph抗原均呈现单一清晰条带,表明抗原纯度较高(图1D)。稳定性实验表明,Epigraph抗原在37、25、4及−80 °C下孵育1周后仍保持稳定(图S1A)。
我们将SpyTag融合到密码子优化的Epigraph HA基因的C端,将其克隆到pCAGGS载体中,并通过瞬时转染HEK293F细胞获得了Epigraph0-SpyTag、Epigraph1-SpyTag和Epigraph2-SpyTag抗原。SDS-PAGE分析显示,所有三种Epigraph抗原均呈现单一清晰的条带,表明抗原纯度较高(图1D)。稳定性实验表明,Epigraph抗原在37°C、25°C、4°C和−80°C下孵育1周后仍保持稳定(图S1A)。
为制备Epigraph-mi3纳米颗粒(NPs),我们首先评估了SpyCatcher-mi3与Epigraph-SpyTag在不同比例下的结合效率。结果显示,随着Epigraph-SpyTag量的增加,残留的SpyCatcher-mi3逐渐减少。值得注意的是,当SpyCatcher-mi3与Epigraph-SpyTag的摩尔比达到1:4时,SpyCatcher-mi3的减少不再明显,表明支架已达到饱和且存在过量的未结合Epigraph-SpyTag(图S2)。基于这些发现,我们将15 μM的SpyCatcher-mi3与60 μM的Epigraph-SpyTag(mi3 NPs支架与Epigraph抗原的比例为1:4)在4°C下孵育过夜进行体外结合反应,随后通过SEC纯化去除未反应的Epigraph抗原和未结合的mi3 NPs。图1D中的SDS-PAGE结果显示,结合产物Epigraph-mi3呈现单一清晰的条带,明显大于Epigraph抗原和mi3,证实Epigraph抗原已有效结合到mi3 NPs上。这一结果在SEC色谱图中Epigraph-mi3 NPs峰的前移中得到了进一步验证(图1E)。负染TEM显示,mi3 NPs呈现规则形状的球形颗粒,而Epigraph0-mi3 NPs表面模糊,可见明显的突出蛋白,且直径大于mi3 NPs。图1F中Epigraph1-mi3和Epigraph2-mi3 NPs也观察到类似结果。DLS分析证实了颗粒尺寸分布,Epigraph-mi3 NPs的流体动力学直径大于未结合的mi3 NPs(图1G)。
此外,所有 Epigraph-mi3 纳米颗粒的多分散性指数(PDI)值均低于 0.5,表明 Epigraph-mi3 纳米颗粒具有均匀的尺寸分布(表 S1)。
为了探究将 Epigraph 抗原偶联到 mi3 纳米颗粒上是否会影响其热稳定性,我们将 Epigraph-mi3 纳米颗粒分别在 37、25、4 和 -80 °C 下孵育 1 周。结果表明,在 -80 至 25 °C 的测试温度范围内,Epigraph-mi3 纳米颗粒未出现显著降解(图 S1A)。差示扫描荧光法(DSF)结果显示,Epigraph-mi3 纳米颗粒和相应的 Epigraph 抗原表现出相似的热稳定性,具有几乎相同的 Tm 值,这表明 Epigraph 抗原与 mi3 蛋白的融合对其结构稳定性没有显著影响(图 S1B)。由于大多数疫苗建议在冷藏条件下(2 - 8 °C)储存,本研究构建的纳米颗粒疫苗在常规疫苗储存条件下保持了一定程度的热稳定性。
In Vitro Validation of the Antigenicity of Epigraph- mi3 NPs
为表征Epigraph-mi3纳米颗粒的体外抗原性,我们评估了其凝集鸡红细胞的能力及其与商用H9N2血凝素(HA)抗体的结合动力学。实验结果表明,Epigraph-mi3纳米颗粒表现出与天然H9N2病毒粒子相当的凝集活性,在1 mg/mL浓度下凝集效价达到128,而mi3支架未显示任何凝集活性(图1H)。三种Epigraph蛋白和三种Epigraph-mi3纳米颗粒均以剂量依赖性方式与商用HA抗体结合。值得注意的是,Epigraph-mi3纳米颗粒的抗体结合亲和力显著高于可溶性Epigraph蛋白(图1I)。综上所述,这些体外实验数据表明,Epigraph-mi3纳米颗粒保持了与天然病毒颗粒相当的凝集活性和抗原完整性,且与可溶性Epigraph蛋白相比可能具有更强的抗原性。
Phylogenetic Analysis of H9N2 AIVs and Representa- tive Strain Selection
对H9N2流感病毒HA基因的系统发育分析表明,H9N2流感病毒已演化成多个独立分支。根据系统发育树(图2),H9亚型流感病毒被划分为四个谱系:h9.1、h9.2、h9.3和h9.4。其中,h9.1和h9.2谱系与1966年北美早期分离株相关。h9.3谱系分布最为广泛,涵盖亚洲、欧洲、非洲、太平洋地区和北美。h9.4谱系为最大分支,包括h9.4.1(G1样谱系)和h9.4.2(BJ94样谱系),自1994年以来在亚洲多数国家流行。中国境内的H9N2病毒主要属于h9.4.2谱系,该谱系进一步划分为h9.4.2.1、h9.4.2.2、h9.4.2.3、h9.4.2.4、h9.4.2.5和h9.4.2.6。2007年以前,中国H9N2病毒主要属于h9.4.2.1至h9.4.2.4谱系;h9.4.2.6谱系病毒在2010年至2016年间曾短期流行,而h9.4.2.5谱系目前在中国占据主导地位。为评估Epigraph疫苗的交叉反应性,本研究选取了17株具有代表性的H9病毒,分别属于系统发育树中的不同谱系(图2,表S2)。这些毒株的选择充分反映了H9N2病毒的遗传多样性和进化动态,确保了对疫苗广谱效力的全面评估。
Strong Antibody Responses in Mice
将纯化的Epigraph0-mi3、Epigraph1-mi3和Epigraph2-mi3纳米颗粒按等摩尔比例混合,配制出Epigraph疫苗。作为对照疫苗的AL/39灭活疫苗,是通过β-丙内酯(BPL)灭活在鸡胚中培养的AL/39株病毒,随后使用蔗糖密度梯度法纯化制备而成。为评估Epigraph疫苗的免疫原性,小鼠在第0天通过肌肉注射进行初次免疫,3周后进行加强免疫。每次免疫后2周采集血清样本用于后续分析(图3A)。
酶联免疫吸附试验(ELISA)结果显示,AL/39组和Epigraph组均对三种不同的Epigraph蛋白产生了特异性血清免疫球蛋白G(IgG)抗体反应。第二次免疫后,Epigraph疫苗显著提高了HA特异性IgG抗体的水平。第二次免疫后,Epigraph疫苗显著提高了HA特异性IgG抗体的水平。值得注意的是,mi3组也引发了适度的IgG抗体反应。
为进一步评估免疫过程中IgG抗体反应的类型,我们分析了IgG亚型。结果显示,Epigraph免疫小鼠的HA特异性IgG1和IgG2a滴度显著升高,表明诱导了Th1和Th2免疫反应。此外,在整个免疫过程中,IgG1/IgG2a比值始终大于1,表明以Th2介导的抗体反应为主(图3B−D)。当针对不同H9N2毒株的HA蛋白进行评估时,与AL/39疫苗相比,Epigraph疫苗在加强免疫后诱导了显著更高的HA特异性IgG反应(图3E),表明Epigraph免疫在小鼠中诱导了更强的体液免疫反应。
Robust Cross-Reactive Antibody Response against H9N2 AIVs
为评估交叉反应抗体应答水平,每组6只BALB/c小鼠分别接种上述Epigraph疫苗、AL/39疫苗或mi3纳米颗粒制剂。
在初次免疫(图4B)和加强免疫(图4C)两周后,采集小鼠血清样本。采用17株具有代表性的H9N2病毒株(图4A)进行血凝抑制试验。根据世界卫生组织及欧洲药品委员会标准,HI效价≥1:40被视为具有保护效力,该阈值与感染风险降低约50%具有相关性(文献33-35)。实验结果表明,Epigraph疫苗能诱导强烈的交叉反应抗体应答:初次免疫和加强免疫后,分别有52.9%(9/17)和82.4%(14/17)的毒株HI效价≥40。
相比之下,AL/39 灭活疫苗在初次免疫和加强免疫后,分别有 41.2%(7/17)和 64.7%(11/17)的病毒株显示出 HI 滴度≥40。值得注意的是,Epigraph 疫苗在加强免疫后对目前流行的 h9.4 系 H9N2 病毒诱导了 100%的保护性 HI 抗体反应。
对于目前流行的 H9N2 病毒 h9.4.2.5 谱系,Epigraph 疫苗诱导的 HI 抗体滴度显著高于 AL/39 疫苗,但安徽/2018 株和湖南/2018 株除外,这两株与 AL/39 疫苗成分一致或相似。热图直观地展示了 Epigraph 疫苗和 AL/39 疫苗之间广谱 HI 滴度的差异(图 4B、C),突出了 Epigraph 疫苗所引发的更优的交叉反应性抗体应答。
Immunization with the Epigraph Vaccine Protects Mice against Lethal Challenge of Heterologous H9N2 AIVs
为评估Epigraph疫苗对H9N2亚型病毒感染的防护效力,本研究采用三株代表性毒株(江苏/2002、山东/2019和湖南/2018)对免疫小鼠进行攻毒实验,其中江苏/2002株属h9.4.2.1分支,山东/2019和湖南/2018株属h9.4.2.5分支,攻毒剂量为半数致死量(LD50)的10倍。攻毒后连续14天监测感染临床症状及体重变化,当小鼠体重下降≥25%初始体重时实施人道(图5A)。如图5B-D所示,Epigraph疫苗与AL/39疫苗免疫组小鼠仅出现轻微体重下降,且迅速恢复至基线水平,全部存活至实验结束,防护效力达100%。在江苏/2002和山东/2019毒株感染组中,AL/39疫苗组小鼠在感染后6天内呈现轻度被毛蓬松及活动量减少,而Epigraph疫苗组小鼠基本未出现被毛蓬松、嗜睡等临床症状。相比之下,PBS或mi3免疫组小鼠表现出显著体重下降、被毛杂乱、颤抖、食欲减退等症状,最终全部死亡或达到人道干预终点。实验数据证实Epigraph疫苗可诱导针对异源H9N2毒株致死性感染的交叉保护作用。
Immunization with the Epigraph Vaccine Reduces Lung Viral Titers and Pathological Inflammatory after H9N2 Challenge in Mice.
为进一步评估Epigraph疫苗的保护效力,研究团队于感染后3天(图5B-D)检测了肺部病毒载量。结果表明,与PBS组和mi3组相比,Epigraph疫苗显著降低了肺部病毒滴度。在接种Epigraph疫苗并感染江苏/2002毒株的实验组中,感染后3天未检测到肺部病毒脱落,其肺部病毒清除优于AL/39疫苗组。对于山东/2019毒株感染组,Epigraph疫苗组的病毒滴度虽略低于AL/39疫苗组,但差异未达到统计学显著性。而在湖南/2018毒株感染组中,Epigraph疫苗的肺部病毒清除效果不及AL/39疫苗组。这一现象可能源于AL/39疫苗组分与湖南/2018毒株病毒具有的序列同源性,其血凝素(HA)蛋白的氨基酸序列相似度达96.75%(附表S2)。
为评估肺部病理学变化,对感染后3天(dpi)采集的肺组织切片进行苏木精-伊红(HE)染色。如图6A所示,所有PBS组和mi3组小鼠肺组织均呈现严重的细支气管炎和支气管肺炎病理特征,具体表现为肺泡间隔增厚、水肿、间质组织炎性细胞浸润及终末肺泡结构改变。相比之下,Epigraph疫苗免疫组小鼠仅出现轻微肺损伤,表现为可忽略或轻度细胞浸润及较轻微炎症反应。与AL/39疫苗组相比,Epigraph疫苗组肺组织病理学评分显著降低。肺组织切片的组织病理学评估证实,Epigraph疫苗可提供强效保护作用(图6B)。上述结果表明,Epigraph疫苗对H9N2病毒攻击具有高度有效的保护效力。
Partial Protection against H9N2 Challenge Conferred by Passive Serum Transfer in Mice
为评估Epigraph疫苗诱导抗体的保护效力,我们进行了被动血清转移实验。实验组小鼠接种两剂疫苗后,通过终末采血法收集血清。随后通过腹腔注射将收集的血清转移至未免疫小鼠体内(图7A)。血清转移24小时后,受体小鼠表现出与供体小鼠相当的IgG抗体滴度,证实抗体转移成功(图7B)。随后用10倍半数致死剂量的江苏/2002病毒株攻毒受体小鼠,并监测其体重变化与存活率(图7C、D)。接受mi3或PBS组血清的小鼠均在7日内死亡。Epigraph疫苗组和AL/39疫苗组血清受体小鼠虽出现显著体重下降,但部分个体在严重失重后逐渐恢复。
最终Epigraph疫苗组供体血清受体存活率为33.3%(6例中2例存活),AL/39疫苗组达66.6%(6例中4例存活)。上述数据表明,Epigraph疫苗诱导的血清抗体虽能发挥抗病毒攻击作用,但尚不足以提供保护。要实现该疫苗的全面保护效力,可能需要细胞免疫等其他免疫机制的关键协同作用。Immunization with the Epigraph Vaccine Elicits Robust Antigen-Specific T Cell Responses in Mice. T细胞在流感病毒感染期间的病毒清除过程中起着关键作用[36,37]。鉴于被动血清转移实验中血清IgG的保护效果有限,我们推测Epigraph疫苗所赋予的保护作用可能部分由细胞免疫反应介导。为评估Epigraph疫苗诱导的抗原特异性T细胞反应,我们在加强免疫两周后分离了小鼠脾细胞(图8A)。采用流式细胞术定量分析了CD3+CD4+T细胞与CD3+CD8+T细胞的细胞因子分泌情况,具体门控策略如图S3所示。实验结果表明,与AL/39疫苗相比,Epigraph疫苗显著提高了分泌IL-4、IFN-γ和TNF-α的CD3+CD4+T细胞的数量及比例。CD3+CD4+T细胞同时增加IL-4与IFN-γ分泌的现象表明,该疫苗可同时引发Th1和Th2免疫应答(图8B,C)。鉴于细胞毒性T淋巴细胞(CTLs)对流感病毒清除至关重要[38],我们还分析了CD3+CD8+T细胞的细胞因子分泌情况。数据显示Epigraph疫苗显著增强了CD3+CD8+T细胞的活化,表现为分泌IFN-γ和TNF-α的CD8+T细胞数量及比例均大幅提升(图8D,E)。这些研究结果证实,Epigraph疫苗在小鼠体内能诱导强烈的免疫原性和强有力的细胞免疫应答。
我们进一步研究了T细胞免疫应答的交叉反应性。在加强免疫两周后分离小鼠脾细胞,分别采用江苏/2002、山东/2019和湖南/2018株的纯化流感病毒HA1蛋白进行刺激。通过酶联免疫斑点(ELISpot)实验检测T细胞产生的干扰素-γ和白细胞介素-4。如图9A、B所示,Epigraph疫苗在小鼠接种后能针对所有三株病毒诱导高水平的HA蛋白特异性细胞免疫应答。
该疫苗组分泌IFN-γ/IL-4的细胞数量显著高于PBS组、mi3组及AL/39疫苗组,与流式细胞术结果一致。值得注意的是,尽管Epigraph疫苗对江苏/2002株诱导的抗体应答有限(血凝抑制效价检测结果),但仍能引发显著的T细胞应答。结合被动血清转移实验,这些发现表明Epigraph疫苗对江苏/2002株致死性攻击的保护作用主要由细胞免疫介导。
结合被动血清转移实验,这些发现表明Epigraph疫苗对江苏/2002株致死性攻击的保护作用主要由细胞免疫介导。此外,与AL/39疫苗相比,Epigraph疫苗对湖南/2018株诱导的T细胞应答更为强烈。然而根据血凝抑制效价检测,Epigraph疫苗诱导的可检测抗体应答水平相当或相对较弱。这些结果表明Epigraph疫苗能在BALB/c小鼠体内诱导强烈的抗原特异性细胞免疫应答,彰显其作为H9N2亚型病毒候选疫苗的潜力。
讨论
近年来,新型病毒(AIVs)已成为对动物和人类构成重大威胁的病原体。其中,H9N2亚型因其在家禽中的广泛流行及其直接从家禽传播至人类的能力而尤为令人关注。此外,H9N2已被证实能够促进新型重组毒株的出现,这些毒株可感染人类。每年二月,世界卫生组织(WHO)预测北半球即将到来的流感季节中最可能流行的流感毒株,并将此信息提供给疫苗生产商。然而,疫苗的生产和分发在毒株预测后需要约6至8个月。这一漫长的过程为病毒通过抗原漂移进化提供了时间,可能导致变异毒株与所选疫苗毒株匹配不佳。由于流感病毒频繁的抗原漂移,当前流感疫苗的保护谱仍然有限。因此,亟需改进传统流感疫苗平台并开发通用流感疫苗。
选择合适的抗原表位对于开发通用流感病毒疫苗至关重要。在本研究中,我们评估了一种表位优化的通用纳米颗粒疫苗。我们利用Epigraph疫苗设计算法设计了广泛交叉反应的H9N2 HA抗原,以不同病原体群体中的潜在表位覆盖。基于纳米颗粒的抗原呈递系统在我们的疫苗设计中也至关重要。近年来,单个颗粒上展示多种抗原的纳米颗粒已成为一种有前景的疫苗平台,显著增强了对抗原的免疫反应。在我们的系统中,Epigraph疫苗通过mi3纳米颗粒平台递送,HA抗原展示在mi3表面,类似于天然流感病毒颗粒。适当大小的纳米颗粒被树突状细胞(DCs)和巨噬细胞有效捕获和呈递,从而触发强烈的抗原特异性免疫反应。尽管缺乏NA抗原,纳米颗粒表面展示的多个HA优势抗原相较于传统灭活全病毒疫苗具有优势。未来的疫苗评估策略将考虑纳入H9NX亚型病毒。
血凝抑制(HI)滴度是评估流感疫苗效力的标准指标。通常认为HI滴度至少为1:40时,对应人类流感感染风险降低50%,并常被用作“阈值"保护滴度。较高的HI滴度通常与更强的保护作用相关。在本研究中,我们证实Epigraph疫苗诱导了针对17种H9N2 IAV毒株中14种的强烈交叉反应HI抗体滴度。值得注意的是,单剂Epigraph疫苗诱导的针对安徽/2018毒株的抗体滴度与AL/39疫苗相当。此外,Epigraph疫苗在当前流行的H9N2 h9.4.2.5谱系中,针对其他三种人类H9N2毒株(湖北/2019、柬埔寨/2021和香港/2014)诱导的HI抗体滴度显著高于AL/39疫苗。然而,Epigraph疫苗和AL/39疫苗均未诱导针对历史毒株(h9.1-h9.3谱系)的HI抗体反应。这可能是由于在H9N2病毒进化过程中,历史毒株不再流行,导致其表位在整体数据集中罕见。虽然增加Epigraph抗原数量可能覆盖这些罕见表位,但这种方法会稀释关键抗原决定簇。鉴于历史毒株重新出现的可能性较低,Epigraph疫苗在提供针对当前流行毒株的广谱保护以及有效应对H9N2抗原漂移导致的疫苗不匹配问题方面仍然有效。
由于HI滴度长期以来一直是流感疫苗批准的主要依据,大多数商业流感疫苗(如灭活疫苗)旨在诱导强烈的体液免疫反应。然而,针对流感病毒的保护性免疫依赖于体液和细胞免疫反应的密切合作。除了抗体反应外,T细胞在流感防御中起着关键作用。有研究表明,T细胞反应在老年人群中与疫苗保护的相关性更好。然而,传统的商业灭活流感疫苗通常无法诱导强烈的T细胞反应。这一局限性被我们的Epigraph疫苗所解决,其通过T细胞表位覆盖来赋予更强大的T细胞免疫反应。在本研究中,被动血清转移实验显示,Epigraph疫苗诱导的体液免疫反应提供的保护有限,表明T细胞反应在病毒清除中的关键作用。流式细胞术和ELISpot结果证实,Epigraph疫苗诱导了强烈的抗原特异性细胞免疫和针对多种H9N2毒株的交叉反应T细胞反应。与AL/39疫苗相比,Epigraph疫苗免疫小鼠表现出CD4+和CD8+ T淋巴细胞分泌的IFN-γ增强。CD4+ T细胞促进B细胞反应并推动淋巴结和脾脏中病毒特异性CD8+ T细胞的扩增。CD8+ T细胞直接清除感染细胞并抑制病毒复制。值得注意的是,尽管Epigraph疫苗诱导的针对江苏/2002毒株的HI抗体滴度较低,但其通过强烈的T细胞激活提供了保护。此外,一部分激活的T细胞分化为能够赋予长期免疫的长寿命记忆T细胞。这些记忆T细胞维持抗原特异性T细胞受体(TCRs)的持续表达,使其能够迅速识别同源抗原并诱导强烈的二次免疫反应。鉴于此,Epigraph疫苗可能比传统疫苗提供更的长期保护效力。然而,Epigraph疫苗的持久性仍需进一步系统研究。
值得注意的是,由于疫苗类型不同,Epigraph疫苗与AL/39疫苗之间的直接比较并不等同。尽管如此,我们的初步结果突显了Epigraph疫苗作为通用疫苗候选者的潜力。鉴于其与当前流行的H9N2谱系毒株的交叉反应性,Epigraph疫苗在缓解年度毒株预测、生产和免疫挑战方面显示出前景。此外,作为一种体外偶联蛋白纳米颗粒,Epigraph疫苗可使用标准真核和原核蛋白表达系统快速生产。这使得疫苗能够高效供应和储备,便于在疫情爆发前迅速开展全球疫苗接种活动。
材料和方法
Cells, Viruses, and Mice。细胞、病毒与小鼠。HEK293F细胞购自ATCC,并在37°C、85%湿度、5% CO2、120 rpm的摇床培养箱中使用SMM 293-TII表达培养基进行培养。
表位图抗原的设计与表征。首先,从GISAID公共数据库中下载了1966年至2022年11月29日期间在中国分离的H9N2(AIVs)的11,367条HA氨基酸完整编码区序列。去除重复序列和低质量序列后,剩余的6,445条序列使用MAFFT软件(版本7.505)进行比对。提取HA第1-337位(HA1,HA的球状头部结构域)的序列并上传至Epigraph疫苗设计器。运行参数设置为:表位长度:9,疫苗池中序列数量:3。最终生成了三条HA表位图序列(Epigraph0、Epigraph1和Epigraph2)。本研究中使用的表位图及其他蛋白质序列见表S3。将这6445条HA1序列与三条表位图序列合并,使用MAFFT对每个基因片段进行多重序列比对。使用IQ-Tree2(版本2.2.0.3)在Linux系统下对处理后的比对结果进行最大似然法系统发育树分析,参数设置为-bb 1000-bnni -m MFP。系统发育树使用FigTree软件(版本1.4.3)进行图形化展示。
质粒构建。表位图HA基因分别针对人类细胞进行密码子优化,并由生工生物合成。SpyTag和六组氨酸标签通过甘氨酸-甘氨酸-甘氨酸-丝氨酸(GGGS)连接子依次融合在表位图HA的C端,并进一步克隆至哺乳动物表达载体pCAGGS中。SpyCatcher-mi3通过柔性连接子GGS(4)和GGGS连接子分别将SpyCatcher和六组氨酸标签融合至mi3的N端和C端获得。随后将该构建体插入大肠杆菌表达载体pET28a中。
蛋白质表达与纯化。表位图-SpyTag使用真核表达系统进行表达。简而言之,HEK293F细胞在SMM 293-TII表达培养基(M293TII-1,义翘神州)中于37°C、85%湿度、5% CO2、120 rpm的摇床中培养。当细胞密度达到1.2 × 10^6 cells/mL时,以1:2的比例将质粒与聚乙烯亚胺试剂(23966-100,Polysciences)进行瞬时转染。孵育5天后,于8000 rpm、4°C离心1小时去除细胞。收集上清液并通过0.22 μm滤膜(SLGP033RB,默克密理博)过滤。过滤后的上清液使用HyPur T Ni-TED 6FF(His-Tag)预装重力柱(C600801,生工生物)进行纯化。目标蛋白使用含有50 mM HEPES,pH 7.4)、300 mM咪唑和300 mM NaCl的缓冲液洗脱。洗脱液浓缩后使用预先用PBS平衡的Superose 6 Increase 10/300 GL柱(Cytiva)进行尺寸排阻色谱进一步纯化。蛋白质纯度和浓度通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和BCA蛋白质定量试剂盒(E112-02,Vazyme)测定。
SpyCatcher-mi3纳米颗粒(NPs)使用原核表达系统表达,方法如前所述。简而言之,编码SpyCatcher-mi3的pET28a表达质粒转化至大肠杆菌BL21(DE3)细胞中,并在含有卡那霉素的LB固体琼脂平板上于37°C培养16小时。挑取单菌落接种至10 mL含有卡那霉素的LB培养基中,于37°C、200 rpm摇床中培养16小时。将10 mL培养物全部加入1 L含有卡那霉素的LB培养基中,培养至OD600为0.8。使用0.4 mM异丙基-β-D-硫代半乳糖苷(IPTG)于16°C、150 rpm诱导蛋白表达20小时。为纯化SpyCatcher-mi3 NPs,细胞于4000 × g离心10分钟收集。大肠杆菌细胞重悬于100 mL裂解缓冲液(50 mM HEPES、300 mM NaCl、5 mM MgCl2、20 mM咪唑、50 μg/mL脱氧核糖核酸酶和1 mM苯,pH 8.0)中,并使用高压细胞破碎仪(Union-Biotech)于600 bar裂解。细胞碎片于30,000 × g、4°C离心1小时去除。上清液通过0.22 μm滤膜过滤,上样至HyPur T Ni-NTA 6FF(His-Tag)预装重力柱(C600791,生工生物),并用洗涤缓冲液(50 mM HEPES、300 mM NaCl、300 mM咪唑、0.75% CHAPS,pH 8.0)洗涤。进一步使用预先用缓冲液(50 mM HEPES、300 mM NaCl,pH 8.0)平衡的Superose 6 Increase 10/300 GL尺寸排阻色谱柱进行纯化。所有纯化蛋白均按照制造商说明使用ToxinEraser内毒素去除试剂盒(L00338,金唯智)去除内毒素。残留内毒素使用ToxinSensor凝胶凝块内毒素检测试剂盒(L00351,金唯智)检测。
表位图疫苗的制备。为构建表位图-mi3 NPs,将15 μM SpyCatcher-mi3与60 μM表位图-SpyTag(mi3 NPs与表位图抗原比例为1:4)于4°C孵育过夜进行体外偶联反应。随后将混合物高速离心10分钟去除聚集体。进一步使用预先用50 mM HEPES(pH 7.4)和300 mM NaCl平衡的Superose 6 Increase 10/300 GL柱进行尺寸排阻色谱纯化。收集目标蛋白,浓缩后于-80°C保存。表位图疫苗由三种纳米颗粒Epigraph0-mi3、Epigraph1-mi3和Epigraph2-mi3等摩尔比混合而成。
SDS-PAGE。SDS-PAGE分析使用10%凝胶进行,凝胶按照PAGE凝胶快速制备试剂盒(PG112,翌圣生物)说明制备。上样后,凝胶在SDS电泳缓冲液中于150 V运行50分钟,随后用考马斯亮蓝染色。染色1小时后,用Milli-Q水脱色,并使用ChemiDoc XRS成像仪(Bio-Rad)成像。
负染透射电子显微镜(TEM)。负染透射电子显微镜分析将新鲜纯化的蛋白以约50 nM浓度置于辉光放电的碳膜包被的300目铜网上。吸附1分钟后,用2.0%磷钨酸(PTA)染色1分钟并洗涤三次。使用Talos L120C透射电子显微镜(赛默飞世尔科技)进行成像。
动态光散射(DLS)。DLS分析使用Zetasizer Nano分析仪(马尔文帕纳科)表征mi3和表位图-mi3 NPs的尺寸和均一性。简而言之,纯化蛋白于4°C高速离心10分钟去除聚集体,取200 μL上样至一次性尺寸比色皿中。使用Zetasizer Nano分析仪测定纯化蛋白的颗粒分布,每个样品分析三次。使用GraphPad Prism 9软件进一步比较mi3和表位图-mi3 NPs的数量分布。
差示扫描荧光法(DSF)。使用PSA-16仪器(北京佰司特科技)评估目标蛋白的热稳定性。样品稀释至约1 mg/mL,取20 μL稀释样品上样至石英玻璃管(Cat# LG-002,京佰司特科技)。按照制造商说明进行操作。简而言之,以1°C/min的升温速率从30°C线性扫描至100°C,并在330 nm和350 nm波长下测量蛋白荧光强度。热转变中点(Tm)由F350/F330荧光比曲线的斜率确定。每个样品测量三次。使用GraphPad Prism 9软件绘制一阶导数数据。
血凝(HA)和血凝抑制(HI)试验。对于HA试验,在96孔微孔板中制备测试样品的2倍系列稀释液,每孔混合50 μL磷酸盐缓冲液(PBS)和50 μL样品。随后每孔加入50 μL 1%鸡红细胞,于室温孵育30分钟后记录结果。血凝滴度定义为诱导红细胞凝集的样品最高稀释度。采用血凝抑制试验(HI assay)测定免疫小鼠血清样本中的抗体效价,具体操作参照先前文献所述。简言之,将血清样本与3倍体积的受体破坏酶(RDE,Denka Seiken,货号340122)在37°C下孵育18小时,以消除非特异性抑制。随后,将混合物在56°C下孵育30分钟以灭活RDE,并加入6倍体积的PBS,使血清最终稀释至1:10。将血清与鸡红细胞按20:1的比例在4°C下孵育1小时,离心去除红细胞以消除非特异性吸附。在96孔微量滴定板中,用PBS对血清进行2倍系列稀释,每孔加入25 μL血清。随后,每孔加入25 μL含有4个血凝单位(HAU)的H9N2病毒悬液。将板在室温下孵育1小时,然后每孔加入50 μL 1%鸡红细胞悬液,继续在室温下孵育30分钟。抑制血凝的最高血清稀释度即为最终的血凝抑制效价。
ELISA 酶联免疫吸附测定(ELISA)。文献64所述方法进行ELISA结合实验,以评估纯化的Epigraph蛋白或Epigraph-mi3纳米颗粒与市售H9N2血凝素(HA)特异性抗体的结合能力。简言之,将纯化靶蛋白以1 μg/mL浓度包被于ELISA板(每孔0.1 mL),4℃孵育过夜。以PBST洗涤三次后,加入0.2 mL含1%牛血清白蛋白(Sangon Biotech,A600332)的PBST溶液,37℃封闭2-3小时,再次PBST洗涤三次。随后加入起始浓度为4 μg/mL的H9N2 HA兔源抗体(Sino Biological,11229-RP02)进行1:4梯度稀释孵育1小时,PBST洗涤五次后,每孔加入0.1 mL辣根过氧化物酶(HRP)标记的羊抗兔IgG抗体(Abbkine,A21020;1:10,000稀释),37℃孵育1小时。经五次洗涤后,加入0.1 mL 3,3,5,5′-四甲基联苯胺(TMB)显色底物(Solarbio,PR1200),以0.1 mL H₂SO₄终止反应后测定450 nm吸光度。 小鼠血清抗体检测采用相同包被、孵育及显色流程,分别使用HRP标记的羊抗鼠IgG(ProteinTech,SA00001−1)、IgG1(ProteinTech,SA00012−1)或IgG2a(ProteinTech,SA00012−2)抗体(1:10,000稀释)作为二抗检测血清样本中相应抗体水平。
小鼠免疫与组织采集。免疫前将Alum佐剂(77161,Thermo Fisher Scientific)以1:1体积比加入免疫原溶液,孵育30分钟使抗原有效吸附于佐剂颗粒表面。雌性BALB/c小鼠(6-8周龄,n=6)分别经肌肉注射接种10 μg Epigraph疫苗(含Epigraph-mi3纳米颗粒各3.33 μg,总量10 μg)或10 μg AL/39疫苗。初次免疫3周后加强免疫。阴性对照组使用4.55 μg mi3(与Epigraph-mi3纳米颗粒等摩尔量)。每次免疫以双股四头肌两点注射(每点50 μL)方式实施。免疫后两周经眼眶静脉丛采血收集血清用于免疫效力评估。末次免疫两周后取脾脏样本分析细胞免疫应答。
小鼠流感攻毒实验。采用Reed-Muench法测定各病毒株的50%小鼠致死剂量(LD₅₀)。雌性BALB/c小鼠(6-8周龄,n=10)接种AL/39疫苗、Epigraph疫苗或mi3安慰剂。加强免疫3周后,麻醉小鼠,鼻内接种10 LD₅₀剂量的小鼠适应株A/Chicken/Jiangsu/7/2002、A/chicken/Shandong/005/2019及A/chicken/Hunan/06.22_YYGK5T3-OC/2018(25 μL)。攻毒后第3天处死各组4只小鼠取肺组织,通过TCID₅₀和qPCR测定肺内病毒载量。部分肺叶经4%中性缓冲福尔马林固定、石蜡包埋切片后,进行苏木精-伊红(HE)染色分析。剩余6只小鼠监测2周内体重变化,当体重下降至初始值25%时实施。
血清被动转移实验。供体BALB/c小鼠按上述方案免疫,加强免疫3周后收集血清检测IgG抗体。混合血清经56℃孵育30分钟灭活后,以每只200 μL剂量腹腔注射至受体小鼠。24小时后经眼眶采血测定IgG滴度,随后以10 LD₅₀江苏/2002毒株攻毒,每日监测体重与存活率至14天。
细胞内细胞因子染色与流式细胞术。采用流式细胞术评估免疫小鼠脾脏抗原反应性T细胞。裂解红细胞后的脾细胞以15 μg/mL Epigraph0/1/2蛋白混合物刺激16小时,加入布雷菲德菌素A继续孵育10小时。依次进行Fixable Viability Stain 510(564406,BD Biosciences)活力染色、Fc受体封闭(S0B0599,STARTER),以及FITC仓鼠抗鼠CD3ε(553061)、PerCP-Cy5.5大鼠抗鼠CD8α(551162)、BV421大鼠抗鼠CD4(562891)表面标记(4℃避光25分钟)。固定透化后,采用PE标记大鼠抗鼠IL-4(554435)、PE-Cy7标记大鼠抗鼠IFN-γ(557649)、APC标记大鼠抗鼠TNF(554420)进行胞内染色(4℃避光30分钟),通过BD LSRFortessa X-20流式细胞仪检测,FlowJo v10.8.1软件分析细胞因子特异性T细胞比例。
酶联免疫斑点(ELISpot)检测。分离的脾细胞以1×10⁵/孔密度与1 μg HA1蛋白(江苏/2002、山东/005/2019或湖南/06.22_YYGK5T3-OC/2018株)在5% CO₂、37℃条件下共孵育24小时。依次加入生物素化抗IFN-γ/IL-4抗体(37℃ 1小时)及酶标链霉亲和素(37℃ 1小时)。阳性对照组加入佛波酯/离子霉素刺激,阴性对照组不处理。采用ImmunoSpot Analyzers自动计数仪检测斑点形成单位(SFU)。
统计学分析。组间比较采用双尾t检验,多组比较采用单因素方差分析(Tukey多重检验)。所有分析通过GraphPad Prism 9软件完成,显著性阈值设定为p<0.05。具体统计方法见图表注释。
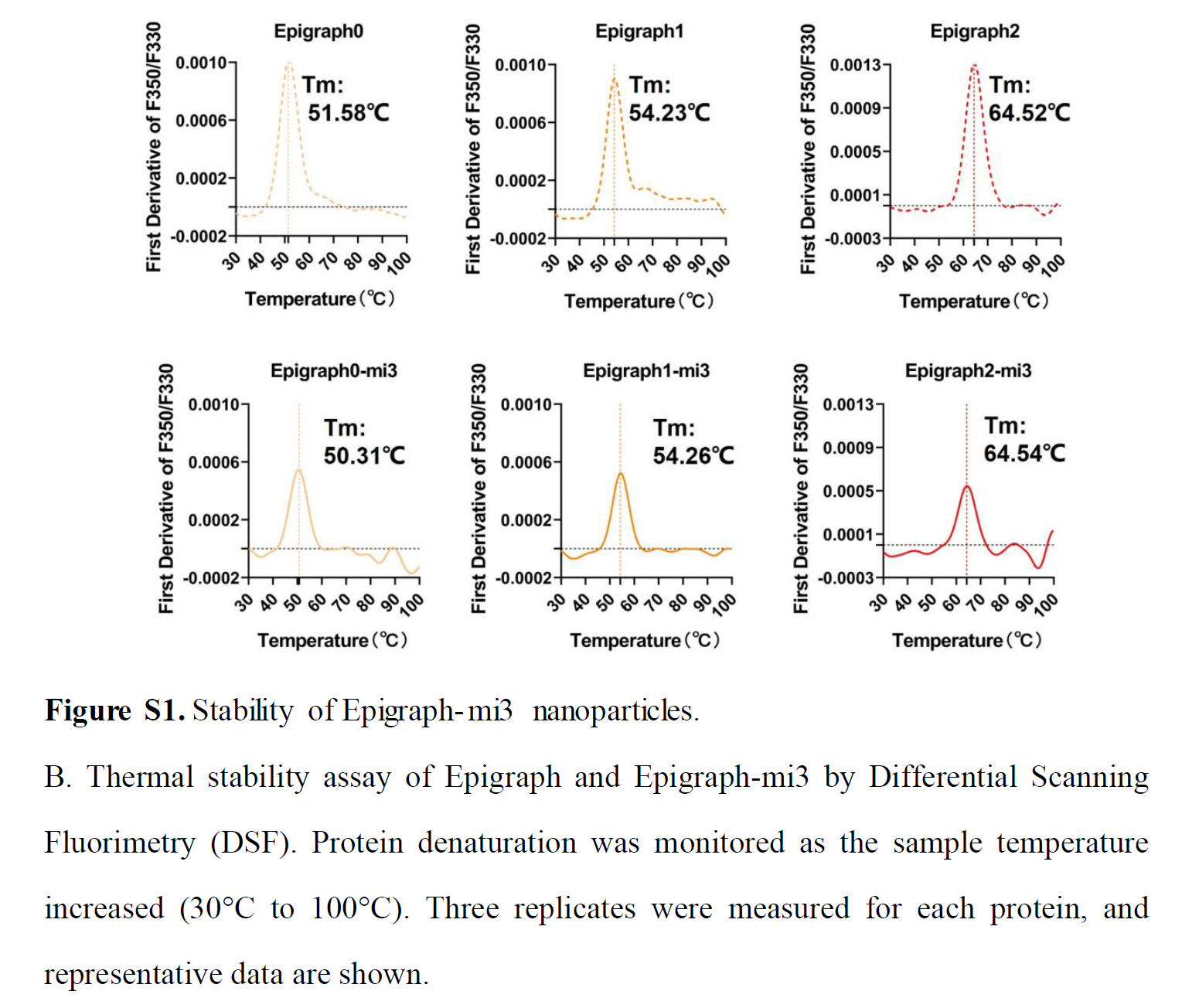
差示扫描荧光法(DSF)。使用PSA-16仪器(北京佰司特科技)评估目标蛋白的热稳定性。样品稀释至约1 mg/mL,取20 μL稀释样品上样至石英玻璃管(Cat# LG-002,京佰司特科技)。按照制造商说明进行操作。简而言之,以1°C/min的升温速率从30°C线性扫描至100°C,并在330 nm和350 nm波长下测量蛋白荧光强度。热变性中点(Tm)由F350/F330荧光比曲线的斜率确定。每个样品测量三次。使用GraphPad Prism 9软件绘制一阶导数数据。

蛋白稳定性分析仪PSA-16
北京佰司特科技有限责任公司于2023年推出了自主研发的第一款国产的蛋白稳定性分析仪PSA-16。
PSA-16的性能和参数达到进口设备的水平,价格却远低于进口产品,弥补了目前国产自主设备在蛋白稳定性研究分析领域的空白。
主要参数★ 测定参数:Tm、Cm、ΔG等;
★ 样品通量:16个;
★ 样品体积:≤20 uL;
★ 浓度范围:0.01-200 mg/ml;
★ 温控范围:15-110度;
★ 变温速度:0.1-15度/分钟;
★ Tm重复性:CV小于1%;
★ 耗材参数:一次性,无需清洗;
★ 八联排设计,适配多通道移液器;
多功能蛋白稳定性分析仪PSA-16基于内源差示扫描荧光(ifDSF)技术,广泛应用于蛋白质稳定性研究、蛋白质类大分子药物(抗体)优化工程、蛋白质类疾病靶点的药物小分子筛选和结合力测定等领域,具有快速、准确、高通量等诸多优点。蛋白质中色氨酸/酪氨酸的荧光性质与它们所处的环境息息相关,因此可以通过检测蛋白内部色氨酸/酪氨酸在加热或者添加变性剂过程中的荧光变化,测定蛋白质的化学和热稳定性。
PSA-16采用紫外双波长检测技术,可精准测定蛋白质去折叠过程中色氨酸和酪氨酸荧光的变化,获得蛋白的Tm值和Cm值等数据;测定时无需额外添加染料,不受缓冲液条件的限制且测试的蛋白质样品浓度范围非常广(10 µg/ml - 250 mg/ml),因此可广泛用于去垢剂环境中的膜蛋白和高浓度抗体制剂的稳定性研究。此外,PSA-16具有非常高的数据采集速度,从而可提供超高分辨率的数据。同时PSA-16一次最多可同时测定16个样品,通量高;每个样品仅需要15 uL,样品用量少,非常适合进行高通量筛选。PSA-16操作简单,使用后无需清洗,几乎无维护成本。
多功能蛋白稳定性分析仪PSA-16应用涵盖植物、生物学、动物科学、动物医学、微生物学、工业发酵、环境科学、农业基础、蛋白质工程等多学科领域。蛋白质是最终决定功能的生物分子,其参与和影响着整个生命活动过程。现代分子生物学、环境科学、动医动科、农业基础等多种学科研究的很多方向都涉及蛋白质功能研究,以及其下游的各种生物物理、生物化学方法分析,提供稳定的蛋白质样品是所有蛋白质研究的先决条件。因此多功能蛋白质稳定性分析系统在各学科的研究中都有基础性意义。
1. 抗体或疫苗制剂、酶制剂的高通量筛选
2. 抗体或疫苗、酶制剂的化学稳定性、长期稳定性评估、等温稳定性研究等
3. 生物仿制药相似性研究(Biosimilar Evaluation)
4. 抗体偶联药物(ADC)研究
5. 多结构域去折叠特性研究
6. 物理和化学条件强制降解研究
7. 蛋白质变复性研究(复性能力、复性动力学等)
8. 膜蛋白去垢剂筛选,膜蛋白结合配体筛选(Thermal Shift Assay)
9. 基于靶标的高通量小分子药物筛选(Thermal Shift Assay)
10. 蛋白纯化条件快速优化等

