人体类器官作为药物研发的三维体外平台:机遇与挑战
人体类器官作为药物研发的三维体外平台:机遇与挑战
引用文献:Human organoids as 3D in vitro platforms for drug discovery: opportunities and challenges
Nature Reviews Drug Discovery
Daisong Wang, Remi Villenave, Nadine Stokar-Regenscheit & Hans Clevers
摘要
类器官是从干细胞衍生出的三维结构,能够重现相应组织的关键结构和功能特征。与传统的二维细胞系相比,人体类器官能提供更接近人体生理的实验模型。其能够捕捉人体组织的复杂性和异质性,有助于研究疾病机制、药物疗效和毒性。由患者样本建立的类器官还能评估个体对药物的反应。在本综述中,我们探讨了类器官在药物发现中的应用。我们概述了生成和维持类器官的当前方法,考察了其在疾病建模、药物筛选和安全性评估方面的应用,并考虑了监管方面以及其在药物发现中更广泛应用所面临的挑战。衰新型肝脏环试验将改变药物安全性评估。
章节
介绍
疾病建模
安全性评估的应用
类器官吸收和代谢的检测
当前挑战的潜在解决方案
监管机构的挑战与机遇
结论
介绍
类在药物研发领域,体外模型发挥着关键作用,为研究细胞对药物的反应提供了明确的实验系统。人类细胞系一直以来都是药物研发的主力,这得益于其相对简单、成本低以及在各研究实验室中易于获取的特点。细胞系通常源自肿瘤,并已被适应在二维塑料表面生长。因此,细胞系无法代表组织结构,也不包含个体器官中所有功能细胞类型。这促使人们探索更接近生理状态的三维培养系统,例如类器官,它们能更精确地模拟体内微环境。与动物实验相比,类器官更具成本效益,能够进行高通量筛选(HTS),同时避免了动物实验中的物种差异和伦理问题。Mina Bissell及其同事通过使用基质胶(一种类似细胞外基质的水凝胶)开创了上皮细胞的三维培养。在三维基质胶培养环境中,细胞之间以及细胞与基质之间的相互作用更接近生理状态。事实上,Mina Bissell证明了,从乳腺中提取的上皮细胞在基质胶中能够形成三维的腺体结构,这些类器官甚至能够被诱导分泌乳汁。
利用多能干细胞(PS 细胞)的类器官技术的发展可追溯到 20 世纪 80 年代胚胎干细胞(ES 细胞)。ES 细胞仅存在于囊胚期胚胎中,但在特定条件下可长期培养,理论上在合适的生长因子条件下可分化为任何细胞类型,如神经元或心肌细胞。由于 ES 细胞来源于早期人类胚胎,其使用面临诸多物流和伦理方面的挑战,这些问题在 2006 年由Shinya Yamanaka发明诱导多能干细胞(iPS 细胞)后得到了很大程度的解决,他通过转染仅四种转录因子将成体组织中的体细胞重编程为 iPS 细胞。对 PS 细胞的研究最初主要采用二维培养方法。当科学家开始探索三维培养技术,如球状 iPS 细胞聚集时,发现 PS 细胞能够自发形成更复杂的结构。基于多能干细胞(PS 细胞)的类器官模型出自Yoshiki Sasai团队,他们构建出了类似视网膜和中枢神经系统(CNS)其他部分的结构。这些结构能够自我组织,重现实际器官的关键特征,包括细胞类型多样性和空间组织。代表各种人体组织的基于 PS 细胞的类器官生成标准化方案正在以越来越快的速度开发出来。这些方案通常需要数周或数月时间,从少量的诱导多能干细胞(iPS 细胞)开始,重点在于优化营养供应,同时模拟发育过程中信号环境的顺序变化,引导 PS 细胞向目标组织分化(图 1a)。常见的 PS 细胞衍生类器官能够模拟脑、视网膜、肺、肾、肝和肠。

图 1 | 多能干细胞和组织干细胞来源的人体类器官。a,诱导多能干细胞(iPS 细胞)来源的类器官生成流程。从 iPS 细胞生成类器官需要逐步进行谱系特化,模拟体内胚胎发育过程,从多能性逐步发展到目标器官。iPS 细胞通常以细胞团的形式收获,保持细胞间接触,并自发形成复杂结构。首先通过应用适当的微环境因子将 iPS 细胞定向诱导至特定的胚层,然后利用组织特异性发育信号进一步分化为特定器官的细胞类型。生成的类器官通常达到胎儿晚期的发育阶段。图中指出了参与胚层特化以及细胞类型特异性分化或成熟的代表性信号因子。b,组织干细胞(TSC)来源的类器官生成流程。组织被处理成单细胞或小片段,直接嵌入细胞外基质(如基质胶)中进行三维培养。由于细胞源自目标器官的活检样本,因此绕过了多能干细胞衍生类器官所必需的谱系定向分化。基于肿瘤干细胞的类器官培养只需要一些因子来支持其长期的增殖,因此通常需要更少的时间来建立。在 TSC 衍生的类器官中,功能性细胞类型的分化可以自发地与干细胞的自我更新同时发生,也可以通过使用细胞类型特异性微环境因子进一步诱导。TSC 衍生的类器官可以从含有活跃干细胞的组织(如消化道)中高效建立,而非自我更新的组织(如脑、视网膜、心肌)只能从诱导多能干细胞(iPS 细胞)中生成。疾病相关的基因突变可以通过基于 CRISPR 的基因编辑引入类器官模型。这一过程需要编辑后的细胞具有高度的增殖能力,以支持其从单个细胞生长,因此基因编辑通常在 iPS 细胞或 TSC 中进行,然后再进行谱系特性分化和细胞分化。ALK:间变性淋巴瘤激酶;BMP:骨形态发生蛋白;EGF:表皮生长因子;FGF:成纤维细胞生长因子;HGF:肝细胞生长因子;HHi:刺猬抑制剂;IGF:胰岛素样生长因子;OSM:癌细胞抑制因子 M;RA:视黄酸;TGF:转化生长因子;VEGF:血管内皮生长因子;VitC:维生素 C。

实际上,几乎每个器官都有通过其组织干细胞(TSCs)来替换受损或老化细胞的能力,除了心脏肌肉、肾小球以及中枢神经系统的大部分区域。骨髓中的造血干细胞是ZUI早被发现的组织干细胞。后来,在皮肤、角膜和肠黏膜等组织中也发现了上皮组织干细胞。2009 年,我们证明了单个来自肠上皮的组织干细胞能够不断增殖,生成包含所有相关细胞类型的肠类器官,展示了组织干细胞及其子代细胞固有的自我组织能力。与诱导多能干细胞类似,特定的生长因子和细胞外基质成分对于引导组织干细胞的扩增和分化成所需的各类细胞至关重要(图 1b)。与基于多能干细胞的方法相比,基于组织干细胞的类器官是从活检样本或其他原代组织来源建立的(而非基于诱导多能干细胞培养),并且不需要在体外谱系特性分化。
过去十年间,类器官研究的数量迅速增长,该技术似乎已准备好开始实现其在药物开发方面的诸多预期。类器官为体外实验提供了模型,能够补充传统的二维人类细胞系和动物模型(表 1)。如上所述,细胞系几乎无一例外地发生了某种形式的恶性转化,要么是因为它们源自癌症,要么是因为它们在塑料表面的二维生长环境中经过了大量适应。实际上,移植细胞系通常会形成肿瘤,而移植类器官则会产生健康且功能正常的组织。与细胞系相比,动物模型的优势在于能够在整个生物体的背景下重现生物现象,但它们也有局限性:由于物种间的固有差异,许多人类疾病难以在动物身上复制。同样,动物与人类之间的生理差异也限制了药物安全性和有效性的准确预测。此外,由于伦理方面的考量,动物的使用正受到越来越多的监管。2022 年,美国国会通过了《食品药品监督管理局现代化法案 2.0》,随后又通过了《法案 3.0》,以明确在药物研发中对动物模型的需求。最近,美国食品宣布有意逐步淘汰在单克隆抗体疗法及其他药物研发中的动物实验。因此,监管机构正在积极探寻替代方法。
在这篇综述中,我们概述了类器官生成和维持的方法,并强调了其在疾病建模、治疗方法筛选以及药物药理学和毒理学评估方面的应用。我们还讨论了其在个性化医疗中的潜力,即可以从患者自身细胞中衍生出类器官,从而实现个体化药物测试。最后,我们探讨了监管方面的考虑以及类器官平台要成为药物开发中成熟工具所必须应对的挑战。
疾病建模
类器官已被应用于多种疾病领域,包括遗传疾病、癌症和传染病(图 2)。

图 2 | 疾病建模中的不同类型的类器官。类器官复制了真实器官的(病理)生理特征,如大脑、肾脏、肝脏、肺和肠。与永生化细胞系相比,类器官展现出复杂的组织结构,具有区域特异性和正确的细胞极性。它们包含成熟的细胞谱系,有助于进行功能检测。值得注意的是,类器官表达关键受体和细胞内成分,能够支持病原体感染,并支持这些病原体的完整生命周期。这些独特特征(总结于上部图表)使类器官在疾病建模中具有重要价值,包括遗传疾病、感染和各种癌症。此外,通过引入诸如免疫细胞等微环境成分,类器官能够模拟和研究炎症性疾病,并为疾病机制和潜在治疗方法提供见解。所建模的疾病示例显示在下部图表中。MASH,代谢功能障碍相关脂肪性肝炎;EEC,肠内分泌细胞;SARS-CoV-2,严重急性呼吸综合征冠状病毒2型。
遗传性疾病
人类类器官似乎特别适合用于模拟遗传疾病。它们既可以由患者的患病器官活检样本直接获得(患者来源的类器官,简称 PDOs),也可以通过 CRISPR 基因编辑技术对从健康个体获取的类器官进行基因编辑而获得。
囊性纤维化(CF)是一种常染色体隐性遗传病,由 CFTR 基因的功能缺失性突变引起。该基因编码氯离子/碳酸氢根离子通道囊性纤维化跨膜传导调节因子(CFTR),其对于包括肺和肠道在内的多种上皮组织的离子和体液平衡至关重要。已开发出几种 CFTR 调节剂,例如 Orkambi,它由两种化合物(依伐卡托和卢马卡托)组成,并已研发成功特别是针对纯合 CFTRΔ508 突变的患者,这类患者约占囊性纤维化患者总数的 50%。即使携带相同的基因突变,患者对这种药物的反应也各不相同,因为 CFTR 调节剂的活性会受到细胞和遗传背景的影响。值得注意的是,人类和现有的小鼠模型在遗传基础和由此产生的囊性纤维化症状方面也存在很大差异。携带 Cftr 突变(包括 CftrΔ508 )的小鼠不会出现囊性纤维化患者所观察到的严重气道疾病,如黏液积聚、气道阻塞或慢性肺部感染。囊性纤维化是首SHOU个借助 PDO 实现个性化医疗方法的疾病。
CFTR 通道由 cAMP 激活。在健康的肠道或呼吸道类器官中,加入福司可林(一种通过刺激腺苷酸环化酶将 ATP 转化为 cAMP 从而提高 cAMP 水平的化合物)会引发快速肿胀,这是由于 CFTR 介导的水流入腔内所致。相比之下,来自囊性纤维化患者的组织类器官对福司可林无反应,不会出现肿胀。这种肿胀失败可通过基于 CRISPR 的 CFTR 突变校正 44 或使用有效的 CFTR 调节剂来挽救。重要的是,在这种肿胀测定中测量的药物反应与患者的临床结果(如一秒用力呼气容积占预计值百分比(ppFEV1)和痰细胞计数(SCC))密切相关。组织类器官肿胀测定的简单性也使其适用于药物高通量筛选。
原发性纤毛运动障碍(PCD)是一种影响呼吸道的遗传性疾病,由与纤毛结构相关的基因突变引起,包括 DNAH5/11、DNAI1 和 CCDC39/40 等基因。利用原发性纤毛运动障碍患者的鼻腔气道类器官可以对其进行研究。这些类器官能够通过电子显微镜成像直接观察到纤毛的摆动情况以及结构变化。在该类器官模型中,基因治疗的潜力已得到证实。
通过先导编辑技术对 DNAH11 基因的突变进行校正。由 SFTPB(编码肺表面活性物质相关蛋白 B)和 SFTPC 等基因突变引起的表面活性蛋白缺乏会导致家族性肺纤维化。肺泡Ⅱ型(AT2)细胞产生的表面活性蛋白可降低肺泡气液界面的表面张力,从而防止呼吸时肺泡塌陷(肺不张),有助于肺部更轻松地扩张和高效地进行气体交换。最近,有报道称从胎儿肺中分离出的 AT2 细胞类器官,而源自 SFTPB 缺陷患者诱导多能干细胞(iPS 细胞)的肺类器官重现了特征性的异常板层小体形成,通过重新表达野生型 SFTPB 可以挽救这一缺陷。
肾脏疾病也可以通过类器官进行建模。多囊肾病(PKD)是见的遗传性肾病,研究人员利用携带 PKD1 或 PKD2 基因突变的患者的肾脏类器官对其进行了研究,PKD1 和 PKD2 分别编码多囊蛋白 1 和多囊蛋白 2。这些类器官重现了常染色体显性多囊肾病(ADPKD)的标志性特征——囊肿形成,同时也表达了 ADPKD 的基因特征。利用可扩展的 ADPKD 类器官进行高通量筛选,已发现了一些有望抑制囊肿生长的化合物,其中包括喹唑啉,这是一种潜在的核因子-κB(NF-κB)通路调节剂。最近,研究人员利用携带 PKHD1 基因突变的诱导多能干细胞(iPS 细胞)衍生的肾脏类器官建立了一个器官芯片平台(见方框 1 和图 3a),PKHD1 编码纤维囊蛋白。该系统模拟了天然组织微环境中的流体流动,并重现了常染色体隐性多囊肾病(ARPKD)患者的囊肿形成过程,为药物测试提供了具有临床相关性的表型。
方框1 | 类器官的演变
目前大多数类器官模型缺乏诸如血管、免疫细胞和神经支配等关键组织成分,而这些成分对于重现人体组织的完整生理环境至关重要。研究人员已开始通过将类器官与内皮细胞共培养(“3D 生物打印"或“微工程组装体")或使用微流控系统(“芯片上的类器官")来构建血管网络,从而在类器官模型中创建血液流动通道(图 3)。例如,在肝类器官中加入人类内皮细胞可形成功能性的类似血管结构,从而改善组织功能并模拟肝脏的自然灌注。同样,类器官中缺乏免疫细胞的问题也已通过将免疫细胞群(如巨噬细胞、树突状细胞和T细胞)引入类器官培养中得以解决。在癌症研究中,一种常用的方法是将患者来源的免疫细胞整合到肿瘤类器官中,这使得能够研究肿瘤微环境中的免疫反应,并测试免疫调节疗法。最后,类器官缺乏神经支配的问题已通过将类器官与神经元共培养或加入神经祖细胞以构建神经类器官的方式得到了部分解决。
对于相对均质的不依赖三维结构的类器官,将类器官细胞以二维单层形式培养是一种可行的替代方案。起始细胞团通常在三维培养中生成。二维培养方法可降低孔间差异,提高检测的一致性和可重复性。平铺的单层结构还支持快速和高内涵成像,并便于整合到复杂系统中,例如“器官芯片"(organoid-on-a-chip)技术,用于研究存在基质细胞类型(包括内皮细胞和免疫细胞)时药物的效果。我们最近描述了一种细菌蛋白——耶尔森氏菌侵袭素,它可以涂覆在二维转孔板上,替代基质胶。值得注意的是,二维转孔板系统还能改进药物安全性及代谢测试,这可能需要同时接触类器官的顶面和基底侧。
遗传性肝病。α1-抗胰蛋白酶缺乏症(AATD)是一种由 SERPINA1 基因突变引起的单基因疾病,导致α1-抗胰蛋白酶(A1AT)水平降低。A1AT 主要在肝脏中产生,是一种丝氨酸蛋白酶抑制剂,可保护肺组织免受中性粒细胞弹性蛋白酶介导的破坏。AATD 患者肺部和肝脏受损的风险增加,从 AATD 患者体内获取的肝类器官模型表现出疾病特征,包括 A1AT 聚集、蛋白质分泌减少以及弹性蛋白酶抑制功能受损。该模型为探索基因治疗及其他旨在防止 A1AT 在肝细胞内聚合和聚集的策略提供了机会。
从 JAG1 突变型阿莱吉尔综合征患者体内生成的类器官显示出胆管细胞分化延迟以及管腔内细胞凋亡增加,这反映了体内胆管树的异常情况。由 ATP7B 基因(编码 ATP 铜转运酶β)突变引起的威尔逊病患者的胆管细胞类器官对铜处理表现出更高的敏感性,这是由于铜转运缺陷和细胞内铜的毒性积累所致。尽管 Atp7b 基因敲除小鼠模型能够捕捉到该疾病的一些肝脏特征,如铜过载、炎症和纤维化,但它无法重现患者出现的神经和精神症状。从胆道闭锁患者体内获取的肝类器官表现出异常形态,其特征为多发性空泡、增殖能力下降、顶基极组织结构紊乱以及 CFTR 蛋白水平降低。这些表型与患者胆管阻塞性疾病的表现一致,转录组分析进一步揭示胆管周围存在淀粉样β蛋白沉积,这是该疾病的一个新的病理和诊断特征。
中枢神经系统遗传疾病。帕金森病(PD)的特征是中脑多巴胺神经元的丧失,从而导致运动和非运动症状。由于诱导多能干细胞(iPS 细胞)来源的多巴胺能神经元处于胎儿成熟阶段,因此使用类器官模拟帕金森病的神经退行性表型以及其他通常发病较晚的中枢神经系统疾病仍具有挑战性。因此,大多数研究都集中在使用携带疾病相关突变的类器官来重现早期病理过程,这可以揭示突变特异性的疾病机制。例如,携带 DNAJC6 功能缺失突变的人类胚胎干细胞衍生的中脑类器官(该基因与帕金森病的早发有关)表现出多巴胺神经元发育受损、病理性的α-突触核蛋白聚集、内在神经元放电频率增加以及线粒体和溶酶体功能障碍,这是由于 WNT-LMX1A 信号传导受损所致。值得注意的是,Dnajc6 基因敲除小鼠并不能重现帕金森病相关的表型。同样,携带帕金森病相关富亮氨酸重复丝氨酸/苏氨酸蛋白激酶 2(LRRK2)G2019S 突变的诱导多能干细胞(细胞)来源的中脑类器官重现了患者身上观察到的特征,包括α-突触核蛋白聚集增加和清除受损。进一步分析发现 TXNIP 是 LRRK2 相关帕金森病的关键因素。
在另一个涉及常见神经退行性疾病的例子中,载脂蛋白 E 变体 APOE4 是阿尔茨海默病(AD)ZUI强的遗传风险因素。携带 APOE4 变体的诱导多能干细胞(iPS 细胞)来源的大脑类器官显示出增强的 AD 病理特征,包括 Aβ 和磷酸化 tau 水平升高、细胞凋亡以及突触完整性降低。值得注意的是,除了 APOE4 变体对神经元的直接影响外,一种包含神经元、星形胶质细胞和小胶质细胞的共培养类器官模型揭示了小胶质细胞 APOE4 在 AD 病理中的作用,即通过诱导神经元炎症发挥作用。进一步的转录分析还确定了与 APOE4 变体相关的细胞类型特异性变化,包括神经元突触功能受损、星形胶质细胞 Aβ 摄取减少和胆固醇积累,以及小胶质细胞样细胞形态改变和 Aβ 吞噬作用降低。源自家族性阿尔茨海默病(携带编码淀粉样蛋白前体蛋白的 APP 基因重复或编码早老素 1 或 2 的 PSEN1 或 PSEN2 基因突变)患者的诱导多能干细胞(iPS 细胞)所衍生的类器官会自发形成病理变化,例如淀粉样蛋白聚集、过度磷酸化的 tau 蛋白以及内体异常,而这些病理变化可通过β-和γ-分泌酶抑制剂得以缓解。
尽管过度磷酸化的 tau 蛋白是阿尔茨海默病(AD)的一个标志,但编码 tau 蛋白的 MAPT 基因的突变可导致额颞叶痴呆(FTD),这是一种异质性疾病,其特征为 tau 蛋白聚集以及谷氨酸能皮质神经元的丢失。携带 MAPT 突变(R406W)的诱导多能干细胞(iPS 细胞)来源的大脑类器官已被用于研究 tau 蛋白病的特定机制。R406W 突变通过破坏微管的稳定性导致 tau 蛋白错位和轴突,这也会扰乱突变神经元中的线粒体运输。突变的 tau 蛋白磷酸化程度降低,更容易受到钙蛋白酶介导的切割和片段化。同样,携带另一种 MAPT 突变(V337M)的类器官已被用于研究早期 FTD 的发病机制。这些类器官在多个时间点进行表型评估,以确定 FTD-tau 病理发展的各个阶段。在较晚阶段(4 个月后),观察到 FTD 的特征,包括神经元丢失、tau 蛋白的逐渐积累以及对谷氨酸毒性的易感性。tau 蛋白的积累主要是由于蛋白水解活性缺陷所致,这是由自噬 - 溶酶体途径的破坏引起的,而非 tau 蛋白表达增加。进一步的基因富集分析显示,编码神经元 RNA 结合蛋白的剪接调节基因 ELAVL4 表达增加,导致剪接失调和兴奋性神经元功能受损。这种兴奋性神经元发育的失调会导致兴奋毒性——即兴奋性神经递质(主要是谷氨酸)过度刺激,导致钙离子大量涌入神经元,造成细胞功能障碍,最终导致细胞死亡——以及在发育后期出现细胞凋亡。此外,通过使用脂质激酶抑制剂阿匹莫德(apilimod)可以挽救突变型 tau组织类器官中谷氨酸能神经元的丢失,该抑制剂可阻止谷氨酸受体再循环至膜上,从而减少谷氨酸诱导的兴奋毒性。另一种方法是使用腺相关病毒(AAV)将突变型 tau(P301L)注射到诱导多能干细胞(iPS)来源的前脑类器官中,也能诱导出含有 tau 原纤维的明显 tau 聚集体。除了 MAPT 基因突变外,额颞叶痴呆(FTD)还有多种其他遗传原因,包括导致颗粒蛋白前体蛋白单倍体不足的 GRN 基因突变以及 C9ORF72 基因中的 GGGGCC 重复扩增。由诱导多能干细胞(iPS 细胞)衍生的脑类器官切片模型重现了皮质结构,并表现出 C9ORF72 相关 FTD 的早期分子病理学特征。在这些类器官中,星形胶质细胞中自噬相关蛋白 P62 的水平升高,深层神经元则积累二肽重复蛋白聚(GA)、出现 DNA 损伤并发生核固缩,这些病理变化可通过药物 GSK2606414 得到缓解(参考文献 71)。具有 C9ORF72 扩增的 iPS 细胞衍生的 FTD 类器官还表现出 TDP43 功能障碍加剧,这是急性损伤的关键驱动因素。基于 FTD 类器官的 CRISPR 干扰(CRISPRi)筛选已确定 KCNJ2 抑制为减轻神经退行性过程的有前景的治疗靶点。
神经发育障碍也可以在类器官中建模。脆性 X 综合征(FXS)是由脆性 X 智力低下蛋白(FMRP)的缺失引起的,这是一种 RNA 结合蛋白,可调节参与突触发育和可塑性的特定 mRNA 的翻译,包括脑源性的神经生长因子(BDNF)、代谢型谷氨酸受体(mGluRs)、钙/钙调蛋白依赖性蛋白激酶 II(CaMKII)和突触后致密蛋白 95(PSD95)。在来自脆性 X 综合征患者前脑的类器官中,FMRP 的缺失会导致神经发生、神经元成熟和兴奋性失调。通过抑制磷脂酰肌醇 3-激酶(PI3K)通路可以挽救这些缺陷,但使用 mGluR5 拮抗剂则无效。值得注意的是,针对 mGluR5 的疗法在临床试验中效果有限,但在动物模型中却显示出有希望的结果。对这些脆性 X 综合征类器官的转录组分析进一步揭示了人类 FMRP mRNA 的靶点,如 CDH2,为脆性 X 综合征的治疗开发提供了机制见解和潜在的可药物靶点。该模型的一个显著局限性在于脆性 X 综合征类器官中 GABA 能抑制性神经元的显著减少。因此,进一步研究 FMRP 缺失对 GABA 能神经元发育的影响,将受益于富含 GABA 能神经元的另一种模型系统,如腹侧前脑类器官。此外,这种脆性 X 综合征(FXS)类器官模型无法捕捉细胞类型的多样性及其复杂的相互作用,尤其是涉及星形胶质细胞的相互作用,据报道星形胶质细胞可介导人类脆性 X 综合征神经元异常放电的非自主性校正。最近的一项研究表明,脆性 X 综合征相关蛋白(FMRP)能够抑制由 YTH 结构域含蛋白 1(YTHDF1)介导的神经元翻译。在诱导多能干细胞(iPS 细胞)来源的前脑类器官模型中,一种针对 YTHDF1 的小分子抑制剂逆转了脆性 X 综合征相关蛋白缺乏所导致的发育缺陷。
代谢紊乱
代谢功能障碍相关脂肪性肝炎(MASH)是一种肝脏疾病,其特征是肝细胞内脂质堆积引发慢性炎症和纤维化,全QUAN球约有 5% 的成年人受其影响。MASH 的风险因素包括营养过剩,或者更罕见的遗传性脂质代谢紊乱。由基因改变(如瘦素或瘦素受体突变,或与脂质代谢相关的基因如 Apoa5、Nr1h4、Pparg、Cebpa 的敲除)或饮食因素(高脂饮食、西式饮食或过量糖分摄入)驱动的 MASH 动物模型被广泛使用。然而,这些动物模型并不适合大规模药物筛选,而且物种间的差异也使得研究结果难以直接应用于人类生理学。
肝类器官代表了肝脏组织的三维结构,并重现了原代肝细胞的基因表达谱和细胞功能。源自患者的 MASH 类器官80 或由代谢物刺激诱导的 MASH 类器官81 捕获了疾病的关键特征,其特征为促炎通路和肿瘤相关标志物的上调、脂质积累增加以及对细胞凋亡的敏感性增强。例如,一种在游离脂肪酸(FFA)处理后出现脂质积累的肝类器官系统已被用于研究二甲双胍和左旋肉碱的作用,这两种药物均用于治疗 2 型糖尿病(T2D)82。源自沃尔曼病患者的肝类器官——该病由溶酶体酸性脂肪酶(LAL)的遗传功能障碍导致甘油三酯水解受损引起——表现出大量脂质积累和严重的脂肪性肝炎。这些表型可通过使用成纤维细胞生长因子 19(FGF19)治疗得到缓解,FGF19 可激活法尼醇 X 受体(FXR)以降低脂质储存诱导的活性氧(ROS)活性83。其他化合物也在肝脏相关类器官模型中进行了评估,结果喜忧参半。尽管有报道称镁能改善 2 型糖尿病和肝脏代谢紊乱,但在 3D 器官模型中,镁对逆转疾病表型无效。相比之下,索拉非尼是一种临床上用于治疗肝癌和肾癌的广谱酪氨酸激酶抑制剂,在 3D 共培养模型中显示出减少脂肪变性诱导的纤维化生成的潜力。
值得注意的是,脂肪性肝炎相关肝纤维化(MASH)中炎症变化与纤维化进展之间的相互作用涉及库普弗细胞(KCs)和肝星状细胞(HSCs)的相互影响。源自诱导多能干细胞(iPS 细胞)的多细胞类型肝类器官已被用于研究 MASH 的发病机制并促进药物筛选。在此系统中,游离脂肪酸(FFAs)可刺激前胶原蛋白的生成。长期的脂肪酸暴露会导致库普弗细胞中炎症细胞因子表达增加、肝星状细胞活化以及类器官硬度升高。这些发现强调了生成多谱系相互作用对于改进 MASH 模型的重要性。
类器官不仅能够模拟代谢疾病,还促进了新疗法的发现。来自家族性高胆固醇血症患者的诱导多能干细胞(iPS)来源的肝细胞揭示了强心苷在降低载脂蛋白 B 生成方面的作用。来自线粒体 DNA 缺乏综合征患者的肝细胞表明,NAD 治疗可改善线粒体功能,通过激活过氧化物酶体增殖物激活受体γ共激活因子 1α(PGC1α)来恢复 ATP 水平。肝细胞类器官对于筛选小分子药物具有重要价值。
在与临床前代谢功能障碍相关脂肪性肝病(MASLD)和 MASH 相关的背景下,我们研究了抑制剂或基于 CRISPR 的功能研究。我们使用胎儿肝细胞类器官来模拟 MASLD 的早期发病情况,分别在遗传性脂肪变性(分别编码载脂蛋白 B 和微粒体甘油三酯转运蛋白的基因)或游离脂肪酸过载的情况下。作为概念验证,常规药物筛选和 CRISPR 介导的失活筛选均可在这些 MASLD 类器官中进行,突出了 FADS2(编码脂肪酸去饱和酶 2)是肝脂肪变性的一个决定因素。
慢性炎症性疾病
对诸如炎症性肠病(IBD)或乳糜泻(CeD)等免疫介导性疾病的建模,需要将类器官与适当的免疫细胞(见方框 1)和/或炎症介质相结合。通过基因组和转录组分析,已确定了众多与炎症性肠病(IBD)相关的风险因素。然而,在动物模型中阐明这些因素的主要细胞靶点及潜在机制却颇具挑战性。源自 IBD 患者93 或暴露于促炎细胞因子的类器官为相关研究提供了便利。例如,对白细胞介素-22刺激的结肠类器官进行分析,发现招募 C-X-C 趋化因子受体 2 (CXCR2)+ 中性粒细胞的基因表达上调。值得注意的是,源自 IBD 炎症黏膜的类器官保留了炎症组织的转录特征,而且儿童 IBD 患者的疾病特异性表观遗传改变在移除炎症环境后仍可在类器官中持续存在。一种具有生理相关性的研究炎症性肠病(IBD)发病机制的一种方法涉及类器官与免疫细胞共培养系统。

图 3 | 疾病建模和药物安全性评估中的类器官系统。a,物质递送和扩散方式。病原体受体和化合物转运蛋白或通道可在细胞顶面不对称分布。传统类器官通常嵌入基质胶中,其基底侧暴露在外(顶面朝内),需要将病原体或化合物微注射到类器官腔内以提高递送效率。通过去除基质胶生成的翻转(顶面朝外)类器官,可减轻递送和扩散方面的挑战,同时保持类器官的三维结构。在二维 Transwell 培养中,类器官细胞的顶面和基底侧均接触环境培养液,从而能够与外部环境进行物质交流。与 Transwell 系统类似,生物工程化的微流控平台通过入口和出口,能够从类器官细胞的顶面和基底侧精确控制物质递送。 b,具有改进的组织级复杂性和组织结构的类器官模型。在无基质胶的悬浮培养系统中,不同类型的细胞混合物可以自发聚集形成组装体,其细胞外基质由内皮细胞和基质细胞等不同类型的细胞提供。尽管组装体显著提高了细胞的复杂性,但它们仍无法准确反映组织的组织结构。生物打印的类器官展现出不同细胞谱系的排列,与天然组织的结构极为相似,即具有更完善的血管网络、神经支配模式和分区。当在生物工程芯片上培养时,不同类型的细胞(如内皮细胞、基质细胞或免疫细胞)可以通过定制设计系统地整合和组织,以实现复杂的组织级结构。
例如,克罗恩病患者的自身黏膜 T 细胞能够浸润类器官并直接诱导上皮细胞死亡。这种浸润和细胞毒性取决于 T 细胞通过 CD103(一种介导 T 细胞与上皮细胞黏附的整合素)和 NKG2D(一种与上皮细胞应激诱导配体结合的激活受体)进行识别。针对 CD103 和 NKG2D 的阻断抗体可靶向免疫细胞与上皮细胞的相互作用,从而减少 T 细胞浸润和上皮损伤。乳糜泻是一种由麸质引发的自身免疫性疾病,与特定的 HLA-DQ 单倍型相关。小鼠自身并不具备这些人类的 HLA 单倍型,尽管已开发出表达人类 HLA 分子的转基因小鼠,但它们并不能完WAN全复制乳糜泻的免疫反应或疾病病理,或者需要人工诱导或基因改造,而这并不能完WAN全模拟自然疾病过程。乳糜泻患者的十二指肠活检样本可以直接在气液界面系统中培养(图 3a),该系统能保留肠道上皮以及多种组织驻留免疫细胞群,从而再现麸质依赖性病理。利用这种共培养系统进行的功能研究表明,IL-7 是一种麸质诱导的致病调节因子,在乳糜泻发病机制中是诱导上皮破坏的必要且充分条件。
甲状腺是器官特异性自身免疫的著ZHU名靶点:甲状腺功能亢进症(格雷夫斯病)和甲状腺功能减退症(桥本甲状腺炎)是自身免疫性疾病,其特征是激素分泌异常。103 可以很容易地生成含有激素分泌细胞的甲状腺类器官。格雷夫斯病自身抗体(已知可激活促甲状腺激素受体 TSHR)作用下的甲状腺类器官表现出细胞增殖增加和激素分泌增多,重现了关键的疾病特征。104 桥本甲状腺炎患者的类器官中趋化因子 CCL2 和 CCL3 水平升高,这两种趋化因子可能在桥本甲状腺炎发病过程中招募免疫细胞方面发挥关键作用。
慢性阻塞性肺疾病(COPD)主要由肺泡和气道受损引起,导致气流受限、黏液分泌增多以及炎症反应,这些因素共同导致呼吸困难。来自 COPD 患者的支气管类器官证实存在杯状细胞增生和纤毛摆动频率降低的情况。通过将人类肺类器官暴露于香烟烟雾提取物中,对吸烟相关的 COPD 进行了研究,结果表明与健康气道类器官相比,香烟烟雾会抑制类器官的形成,并增加肺泡类器官对香烟烟雾的敏感性。
传染病
微孢子虫(Cryptosporidium parvum)是一种能引发腹泻的原生动物寄生虫,其生活周期复杂,包含无性生殖和有性生殖阶段,且一直难以在实验室中培养。人类肠道类器官,尤其是分化出的肠上皮细胞,能够支持微孢子虫生活周期中的无性和有性阶段,并能产生具有与从感染宿主动物体内获取的卵囊相当的二次感染能力的卵囊。同样,人类肠道类器官为人类诺如病毒(HuNoV)提供了体外感染平台,确定了肠上皮细胞是其复制的目标细胞109。HuNoV 感染是急性胃肠炎的主要病因,但传统细胞系无法支持 HuNoV 的感染和复制,而且由于病毒受体和免疫反应的物种特异性差异,小鼠对感染具有天然抵抗力。此外,小鼠诺如病毒模型在病毒结构、受体使用和致病性方面与 HuNoV 存在差异,这限制了研究结果直接应用于人类疾病。肠道类器官克服了这些障碍,表现出对血型抗原的 HuNoV 结合特异性,这与动物和人类研究的结果一致。除了 HuNoV 之外,肠道类器官还被用于模拟其他肠道病毒的感染,包括轮状病毒、柯萨奇 B 病毒和肠道病毒。
2016 年,世界卫生组织宣布寨卡病毒(ZIKV)感染与巴西新生儿小头畸形及其他神经系统疾病群发事件构成国际关注的突发公共卫生事件。由于无法获取活体感染的人类胎儿组织,对寨卡病毒在发育中的中枢神经系统中的发病机制了解有限。小头畸形的表型需要一个三维结构模型,这只能通过感染脑类器官来实现。使用人类诱导多能干细胞(iPS 细胞)衍生的脑类器官进行的实验表明,寨卡病毒感染会破坏大脑皮质层,减少细胞增殖,并降低功能性神经元的数量。在旋转生物反应器中培养的特定区域脑类器官表明,亚洲和非洲的寨卡病毒株均优先且高效地感染神经前体细胞,引发过早分化和细胞死亡增加,这与在人类胎儿中观察到的感染模式一致。脑室区和室管膜下区的前体细胞均可能受到影响,这支持了在人类神经发育过程中增殖的前体细胞是该疾病关键靶点的假设。基于这些类器官模型的机制研究揭示,寨卡病毒蛋白 NS2A 会损害人脑前脑类器官中放射状胶质细胞的增殖,并破坏神经干细胞的顶连接形成。寨卡病毒蛋白 NS4A 和 NS4B 的表达会抑制 AKT-mTOR 信号传导,从而阻碍神经发生并促进自噬。寨卡病毒蛋白 NS5 特异性靶向人类而非小鼠的 STAT2,以抑制 I 型干扰素信号传导。寨卡病毒还能激活 Toll 样受体 3(TLR3)介导的先天免疫反应,导致参与神经发生、轴突导向和细胞凋亡的基因失调。人脑前脑类器官也被用于药物筛选,发现溴化海罂SU碱能消除感染寨卡病毒的人类神经祖细胞中的寨卡病毒,并能挽救寨卡病毒诱导的小头畸形表型。另一项药物再利用筛选发现,泛半胱天冬酶抑制剂艾米卡司能抑制寨卡病毒诱导的半胱天冬酶 3 活性,从而保护类器官培养中的人类皮质神经祖细胞,而美国食品批准的 B 类驱虫药氯LV硝柳胺能阻断寨卡病毒的复制。此外,寨卡病毒(ZIKV)感染通过病毒 NS3 蛋白与钙/钙调蛋白依赖性蛋白激酶 II(CaMKII)的相互作用,增加宿主细胞中瞬时受体电位通道 4(TRPC4)的表达,从而增强 TRPC4 介导的钙内流。药理学上抑制 CaMKII 或 TRPC4 有可能减少癫痫发作,并阻止寨卡病毒在诱导多能干细胞(iPS 细胞)来源的脑类器官中的传播。
呼吸道感染。呼吸道是病原体的主要攻击目标,2019 冠状病毒病大流行促使对体外模型的需求高涨。在分化的人气道类器官中,表达血管紧张素转化酶 2(ACE2)和跨膜丝氨酸蛋白酶 2(TMPRSS2)的气道纤毛细胞是初始感染的主要细胞靶点。鉴于 ACE2 和 TMPRSS2 在多种上皮组织中均有表达,严重急性呼吸综合征冠状病毒 2 型(SARS-CoV-2)能够感染多种上皮细胞。(SARS-CoV-2)在呼吸道初次感染后可传播至其他器官。含有表达 ACE2 的肠上皮细胞的人类肠道类器官能够支持 SARS-CoV-2 的强效感染和复制。后续研究利用 CRISPR 基因编辑技术构建的类器官生物库表明,SARS-CoV-2 以及中东呼吸综合征冠状病毒(MERS-CoV)和 SARS-CoV 特别依赖 TMPRSS2,该蛋白酶可激活刺突蛋白,使病毒包膜直接与宿主细胞膜融合。因此,这些病毒无需通过内吞作用即可感染宿主细胞,这使得 TMPRSS2 成为广谱冠状病毒治疗药物的一个有吸引力的靶点。值得注意的是,(羟)氯LV喹是一种内吞作用阻滞剂,最初基于细胞系研究而被提出,并被广泛用于治疗FEI炎患者。然而,该药物在类器官模型中并不能抑制病毒复制。这一发现与临床观察结果一致,即(羟)氯LV喹对 SARS-CoV-2 无效,这突显了类器官作为筛选新型药物治疗手段的更准确的转化平台的潜力。
更广泛地说,气道类器官可用于研究诸如甲型流感病毒(IAV)、呼吸道合胞病毒(RSV)或人类鼻病毒 C(HRV-C)等呼吸道病毒的感染动态和跨物种传播潜力。它们表达 TMPRSS2 和 TMPRSS4,这两种蛋白可介导 IAV 表面血凝素的切割,从而促进病毒与宿主细胞膜的融合。分化后的二维类器官(见方框 1,另见图 3a)能够区分人类感染性 IAV 与感染性较弱的禽QIN流感和猪流感亚型的复制能力,并已被用于评估近期禽QIN流感 H5N6 和 H5N8 株的溢出风险。长期可扩增的人类气道类器官还能重现 RSV 感染的关键特征,包括由病毒非结构蛋白 NS2 驱动的细胞运动性增强以及共培养期间中性粒细胞的优先募集。同样,它们能够维持 HRV-C 的可重复传播,从而为病毒与宿主的相互作用提供见解。在 HRV-C 感染后,气道类器官比鼻类器官引发更强的先天免疫反应,使用α-CDHR3 和抗病毒DU药物治疗可显著抑制病毒生长,这表明其具有作为抗病毒DU药物开发平台的潜力。
癌症
许多癌症类型,如胰腺癌、肝癌和乳腺癌,在动物模型中不会自发形成。即便通过引入特定的癌症突变来实验性地诱导肿瘤(这通常需要相当长的时间),这些模型仍无法模拟人类癌症的复杂性和异质性,包括其遗传多样性和免疫环境。在过去十年中,患者来源的肿瘤类器官(PDTOs)的出现极大地丰富了癌症的临床前模型库。这些培养物几乎可以从所有癌组织中建立,起始材料可以是活检或切除的组织。它们具有可扩展性,并且能很好地重现原始肿瘤的组织学、遗传学和转录组学特征,还能稳定地移植到小鼠体内进行体内表征。携带特定基因突变的 PDTO 可以在不依赖于通过突变激活的致癌途径所传递的生长因子的情况下独立生长。例如,具有 KRASG12V 突变的类器官可以在缺乏表皮生长因子(EGF)的情况下生长,而 EGF 对健康类器官的生长是必BI不BU可KY少SHAO的,这是区分肿瘤衍生的生长与正常组织生长的常用方法。肿瘤类器官的实用性在药物测试研究中得到了进一步证明,这些研究表明了突变特异性的细胞毒性作用。例如,对不可逆的 ERBB 受体酪氨酸激酶家族抑制剂阿法替尼的敏感性与乳腺癌类器官中的 HER2 表达水平相关。同样,具有 BRCA1/2 突变特征的类器官对聚(ADP - 核糖)聚合酶(PARP)抑制剂更敏感,从而导致肿瘤细胞死亡。此外,通过在野生型类器官中依次进行 CRISPR 工程改造,可以创建出具有特定致癌突变的定义明确的癌症模型。这种人工创建的癌症类器官在异种移植后会产生预期的组织学特征。
类器官肿瘤模型(PDTO)及其对应的健康类器官已在各种肿瘤类型的生物样本库中大量生成并储存(总结于表 2 和补充表 1)。这些 PDTO 反映了肿瘤间和肿瘤内的异质性,有助于研究肿瘤的演变和进展,测试治疗反应的变异性,理解耐药机制并发现新的治疗靶点。例如,MCLA-158(佩托塞单抗)是一种针对 EGFR 和 LGR5 的双特异性抗体,其开发完WAN全基于结肠癌 PDTO 系列(见框 2)。重要的是,PDTO 对抗肿瘤疗法的敏感性与其亲本肿瘤组织相当,这突显了 PDTO 在药物筛选中的可靠性。值得注意的是,在其“初始状态"下,PDTO 系列不包含免疫细胞、肿瘤基质或血管,但通过共培养,借助微流控系统和生物工程技术(如器官芯片和 3D 生物打印)(见框 1,另见图 3b),这些成分可以很容易地被j加入。
尽管具有这些优势,类器官仍是一种高度简化的实验平台,尽管其结果往往稳健且可重复,但在将其常规应用于药物开发之前,必须通过现有的体外平台、动物研究和临床试验数据对其结果进行广泛验证。类器官肿瘤模型在多种癌症类型的个性化医疗方面展现出前景,胰腺癌、胃肠道癌和乳腺癌中的类器官药物反应与临床结果之间存在相关性。然而,其更广泛的可转化性仍有待最终证实,目前正在进行多项随机临床试验以评估其预测价值,尤其是在放疗和化疗环境中。重要的是,在肿瘤学之外,转化证据仍然稀缺,且缺乏严格的临床验证。此外,很少有负面预测数据被报道,这限制了我们对基于类器官预测的局限性的理解。在神经学及其他复杂的系统性疾病中,类器官还面临着模拟多细胞相互作用和全身药代动力学的困难,这限制了其预测效用。
安全性评估的应用
尽管大多数研究都集中在利用类器官进行药物疗效和疾病建模方面,但其在制药行业的应用如今正在扩展,用于评估药物化合物在多个器官中的安全性(表 3)。
肝毒性
肝脏在药物代谢中起着核心作用,肝毒性是导致药物研发失败、上市后撤市或使用受限的主要原因之一。药物性肝损伤(DILI)是药物治疗相关的重要致病和致死原因,其预测和预防仍具有挑战性。源自 TSCs 或 PS 细胞的肝类器官为预测药物性肝毒性提供了很有前景的机会。
表 2 | 用于药物筛选和评估的代表性 PDTO 生物样本库
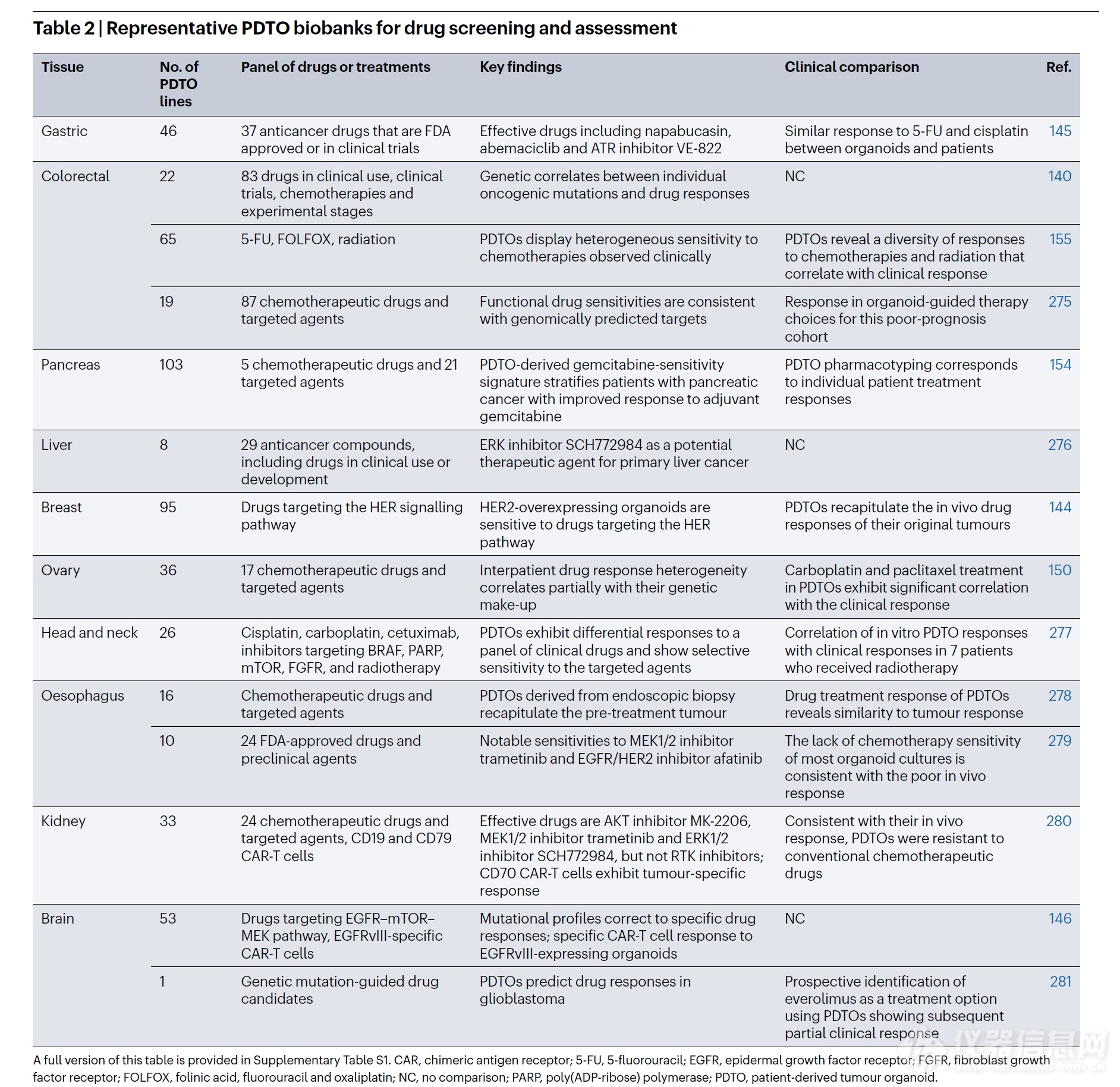
该表的完整版本见补充表 S1。CAR,嵌合抗原受体;5-FU,5-氟尿嘧啶;EGFR,表皮生长因子受体;FGFR,成纤维细胞生长因子受体;FOLFOX,亚叶酸钙、氟尿嘧啶和奥沙利铂;NC,无对照;PARP,聚(ADP-核糖)聚合酶;PDTO,患者来源肿瘤类器官。
来自多能干细胞的功能成熟的类肝器官(HLOs)能够重现曲格列酮(一种因肝毒性而撤市的抗糖尿病药物)、对乙酰氨基酚(也称为扑热息痛;一种广泛使用的镇痛药)以及抗生素特拉氟沙星和左氧氟沙星已知的肝毒性,在临床相关浓度下比二维肝细胞具有更高的敏感性。同样,源自 TSC 的 HLOs 在模拟药物诱导的磷脂沉积症方面优于传统的肝癌细胞系 HepG2,磷脂沉积症是一种与多种药物相关的严重不良反应,这突显了它们评估代谢物介导的肝毒性的能力。此外,多能干细胞衍生的 HLOs 已被用于建立一种高通量检测方法,用于大规模化合物筛选,通过多重读出准确标注了 238 种药物的药物性肝损伤(DILI)潜力,并展示了其在个体供体中模拟波生坦(一种可导致胆汁淤积性肝损伤的内皮素受体拮抗剂)基因型特异性易感性的能力。基于这些进展,人体肝脏模型能够模拟一系列药物性肝损伤相关的表型,包括脂肪变性、纤维化和免疫反应,且使用化合物得出的结果与临床数据高度一致。例如对乙酰氨基酚和 TAK-875(一种曾用于治疗 2 型糖尿病的 G 蛋白偶联受体 40(GPR40)激动剂,后因肝毒性而停止研发)。扩大 HLO 的应用范围,肝内胆管细胞类器官已被用于研究氯LV丙BING嗪诱导的胆管损伤,并证明该模型能有效模拟药物引起的胆道毒性。最近,HLO 已被用于评估腺相关病毒(AAV)载体,这种载体在基因治疗中被广泛应用,尤其是针对肝脏的治疗,为基因治疗开发中评估载体性能和靶向肝毒性提供了新的平台。
肾毒性
由人类多能干细胞衍生的肾脏类器官,尽管仍缺少一些关键转运蛋白和肾小管滤过功能,但能够模拟药物引起的急性肾损伤,这是药物开发中的一个重大安全问题。这些类器官包含肾小球、集合管、肾间质和内皮细胞,并能自我组织成类似肾小球的结构,包括足细胞、近端小管、亨氏袢和远端小管,进一步重现了体内肾小球的组织结构。它们在对顺铂和庆大霉素等肾毒性物质的反应中表现出不同的细胞凋亡情况,肾损伤标志物肾损伤分子 1(KIM1)的表达呈剂量依赖性上调,证明了其在肾毒性测试中的实用性。后续研究进一步完善了肾脏类器官模型,使其能更好地模拟肾毒性反应。顺铂和阿霉素诱导的损伤,包括剂量依赖性细胞凋亡,已在传统类器官、悬浮培养的微类器官以及生物打印的肾脏类器官中得到重现,这些类器官还证明了阿霉素和氨基糖苷类抗生素的毒性。一种具备免疫功能、血管化的肾脏类器官芯片系统,结合了灌注的外周血单核细胞(PBMCs),进一步实现了对免疫介导毒性评估的能力,例如在 T 细胞双特异性抗体(TCB)针对 HLA-A2 呈递的 WT1 肽的响应下,对表达 WT1 的细胞进行选择性杀伤。这突显了该系统能够在动态微环境中评估化学和免疫介导的毒性。
胃肠道毒性
利用类器官模型对小分子和大分子药物的胃肠道毒性进行更准确的预测,能够显著改善临床前的风险效益评估,并减少药物研发过程中的失败率。一项开创性的研究利用源自人类回肠的 TSC 衍生类器官来模拟药物引起的腹泻,建立了一种基于类器官的检测方法,以 31 种参考药物进行验证。该检测方法在预测药物引起的腹泻临床发生率方面准确率达 90%。在此基础上,利用源自 TSC 的小肠和结肠类器官探索了胃肠道毒性的分子决定因素,研究了多柔比星和吉非替尼引起的副作用机制。开发了一种经济高效的肠道类器官培养方法,能够对小分子进行表型高通量筛选,有助于简化临床前工作流程。利用这一平台,未分化的类器官能够准确区分具有细胞毒性或无细胞毒性的化合物。此外,将人类、大鼠和狗类器官对化合物的反应进行比较,揭示了物种特异性的敏感性差异,这与临床前研究结果一致,并证明了类器官在早期安全性评估中的实用性。肠道类器官平台的预测能力还延伸到了对诸如 TCB 等基于蛋白质的生物制剂的“靶向肿瘤外"效应的评估,包括缺乏交叉反应的临床前物种。补充了免疫细胞的肠道 PDO 和肿瘤类器官已显示出 TCB 的组织特异性肿瘤外毒性,成功捕捉到了传统组织模型因缺乏这些免疫成分而无法预测的临床不良反应。在此基础上进一步拓展,通过将上皮类器官与自体组织驻留记忆(TRM)T 细胞整合,生成了人类肠道免疫类器官,并已用于研究癌症患者中观察到的 TCB 引起的肠道炎症。
中枢神经系统毒性
药物诱导的神经毒性是候选药物研发终止的一个主要原因,中枢神经系统不良反应被报道导致了 7%至 34%的早期和后期项目终止。类器官为揭示可能无法通过传统方法检测到的毒性机制提供了强大的模型。较简单的系统,如二维细胞培养,可能会忽略依赖于中枢神经系统微环境复杂细胞相互作用的独特毒性机制,尽管小鼠模型确实复制了中枢神经系统的部分复杂性和多样性,但它们可能无法准确代表人类对毒素的特异性反应。例如,由于缺乏类似于人类脑组织的体外模型,长春新碱神经毒性的机制研究过去一直集中在周围神经元上。最近,由诱导多能干细胞衍生的脑类器官揭示了长春新碱对大脑发育的神经毒性,确定了细胞外基质介导的信号传导,并突出了基质金属蛋白酶在这一过程中的作用。
方框2 | MCLA-158(佩托西单抗),利用专门的癌症类器官生物样本库进行癌症药物研发
靶向亮氨酸富集重复序列含 G 蛋白偶联受体 5(LGR5)和表皮生长因子受体(EGFR)的双特异性抗体 MCLA-158 为类器官技术如何推动药物研发提供了一个说服力的范例。整个发现项目均使用源自患者的结肠癌类器官系进行。生成了一个包含 500 多种双特异性抗体的库,其中一臂靶向 EGFR 家族成员,另一臂靶向包括 LGR5 在内的干细胞标志物。在一组较小的结直肠癌(CRC)类器官系中进行的无偏功能性筛选,以检测生长抑制和形态变化,从而确定了 MCLA-158,随后在更广泛的健康和 CRC 类器官中对其进行了进一步表征。MCLA-158 能够消除 CRC 类器官,但对健康结肠类器官无影响。
MCLA-158 在多种上皮癌的临床前模型中已展现出治疗特性,例如抑制 KRAS 突变型结直肠癌肿瘤生长、阻断转移启动以及抑制肿瘤再生。其研发项目从发现到一期临床试验仅用了 30 个月。正在进行的临床研究包括一线头颈部鳞状细胞癌(HNSCC)的 III 期注册试验(单药治疗 292 及与帕博利珠单抗联合用药 293),以及于 2024 年底启动的转移性结直肠癌晚期治疗的 II 期开放标签试验。
表 3 | 类器官在药物安全性评估中的应用
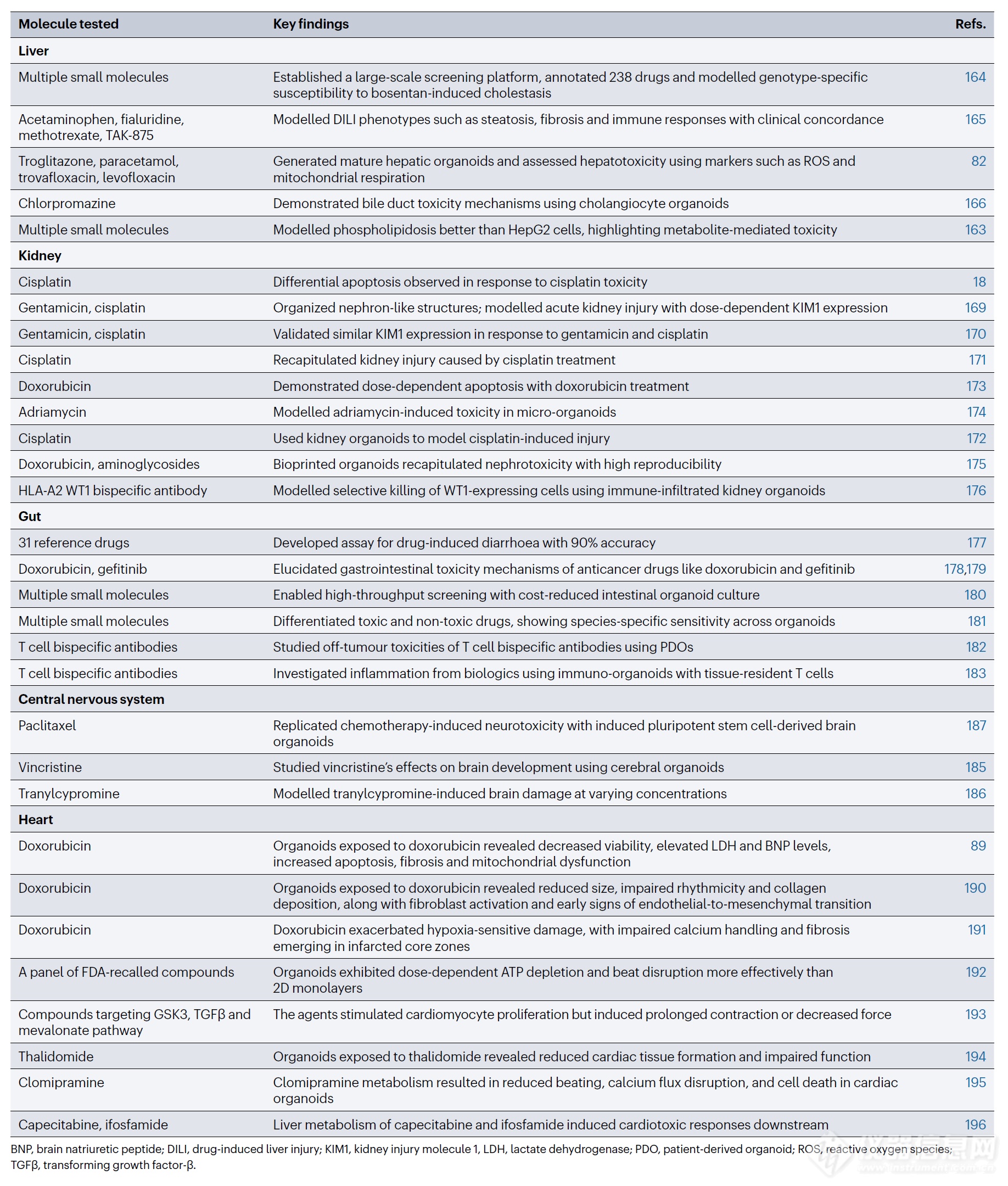
转化生长因子 -β ,TGFβ 。 BNP,脑钠肽;DILI,药物性肝损伤;KIM1,肾损伤分子 1;LDH,乳酸脱氢酶;PDO,患者来源类器官;ROS,活性氧;TGFβ,转化生长因子-β。
这些发现强调了使用复杂的三维脑类器官系统来探究可能涉及发育中的人脑组织结构和细胞复杂性的毒性机制的重要性。脑类器官可以在较长时间内培养,以实现功能成熟。成熟的脑类器官已被用于研究曲唑酮(一种用于治疗难治性抑郁症的药物)对大脑发育的影响,通过转录抑制 BHC110/LSD1 目标基因和组蛋白 H3 赖氨酸 4 去甲基化,发现其对神经元和星形胶质细胞存在剂量依赖性的脑损伤。最近,诱导多能干细胞(iPS 细胞)来源的脑类器官已被用于评估化疗药物紫杉醇引起的神经毒性,证明了类器官在评估小分子诱导的神经毒性方面的实用性。
心脏毒性
尽管预测性临床前检测方法已得到开发和应用,但心脏毒性仍是导致药物研发失败和上市后撤市的主要原因。由干细胞衍生的心肌细胞和支持细胞类型组成的类心脏器官应能重现心脏组织结构、收缩功能和电生理学等关键特征,从而为预测药物对心脏的影响提供一种替代方法。
多柔比星诱导的心脏毒性已在心脏类器官模型中得到模拟。多柔比星暴露会降低类器官的活力,增加乳酸脱氢酶(LDH)和脑钠肽(BNP)水平,并诱导细胞凋亡、纤维化和线粒体功能障碍。在无细胞外基质的模型中,多柔比星治疗会导致类器官、节律性受损、胶原沉积、成纤维细胞活化以及内皮细胞向间充质细胞转化的早期迹象。在模拟缺血后组织的心肌梗死类器官模型中,多柔比星会加剧缺氧敏感性损伤,破坏协调收缩所需的钙循环,并促进梗死核心区域纤维化的出现。心脏类器官平台已被用于筛选一系列临床相关药物。一项评估美国食品召回化合物的研究表明,类器官比二维单层细胞更有效地检测到剂量依赖性的 ATP 耗竭和节律紊乱。此外,高通量筛选还发现了针对 GSK3、TGFβ 和甲羟戊酸途径的促增殖化合物,这些化合物能刺激心肌细胞增殖,但同时会导致收缩时间延长或收缩力下降,表明尽管具有再生潜力,但仍存在功能副作用。空间组织有序的心脏类器官已被用于模拟发育毒性。接触沙利度胺会减少心脏组织的形成并损害其功能,较大的结构显示出更稳定的跳动模式,而较小的结构则表现出舒张延迟和形态变异。最后,多器官平台突显了其他组织中的代谢如何驱动心脏毒性。在肝心共培养中,通过细胞色素 P450 酶将转化为去甲基,会导致心脏类器官跳动减少、钙离子流紊乱和细胞死亡,而当没有肝类器官时则未观察到这些效应,这表明肝细胞是导致观察到的毒性的原因。一个由六种组织构成的平台同样表明,卡培他滨和异环磷酰胺在肝脏中的代谢会在下游引发心脏毒性反应,这突显了器官间相互作用在心脏毒性中的作用。
基于类器官的临床前安全性评估平台
目前,人们正在探索传统类器官预测现有药物安全性的能力,但新一代具有更高复杂性的生物工程类器官平台已展现出进一步提升药物安全性测试的能力(图 3b)。这类模型融合了血管和免疫成分,能够研究药物对组织微环境和全身反应的影响,或者内置实时检测 ATP 与 ADP 比值的生物传感器,以评估药物引起的肾毒性 198。此外,将肝脏、心脏、肺、血管、睾丸、结肠和大脑等多类器官组合在一起的多器官类器官系统已被用于“人体芯片"平台,能够对被美国食品召回的药物进行筛选,并为多器官毒性和全身相互作用提供见解。同样,由肝脏和胰岛类器官组成的微工程组装体被用于测量二甲双胍的活性。
近年来,生物工程改造的二维类器官,如微型结肠和微型肠道芯片平台,通过维持类器官的分化和顶基极性,同时借助流体流动实现腔内通路,进一步拓展了药物安全性评估的能力(图 3a)。在这种设置中,三维类器官被“打开",其外侧或基底表面置于二维基质上,而类器官的内侧/腔内/顶侧表面则可以从上方自由接触。这已被证明对测试针对干细胞的癌症化疗药物(如阿糖胞苷和伊达萨努林)特别有效。这些将类器官生物学与生物工程方法相结合的平台为解决具有日益复杂作用机制的治疗药物所面临的转化安全性挑战提供了新的选择。此外,基于 Transwell 的类器官单层细胞还能利用跨上皮电阻(TEER)测量对上皮屏障完整性进行定量评估,从而提供一种动态的组织极化和紧密连接功能读数 。值得注意的是,作为跨内皮电阻(TEER)测量的替代方法,基于图像的检测方法也已用于测定体外完整肠类器官的屏障完整性,这些方法要么是在培养基中添加荧光染料,然后观察其在屏障降解时的内化情况,要么是直接将染料微注射到类器官的腔内空间,然后量化上皮屏障的渗漏情况。
类器官吸收和代谢的检测
预测药物吸收、分布和代谢的能力对于药物开发至关重要,直接影响药物的药代动力学,从而影响治疗候选药物的预期疗效、安全性和剂量。了解这些参数对于优化药物配方、减轻不良反应以及确保临床成功至关重要。肝脏、肠道和肾脏是负责药物吸收、代谢和清除的主要器官,因此也是制药行业主要关注的体外器官模型。
用于药物代谢的肝类器官
肝脏是药物代谢的主要器官,它促进三个关键过程:某些药物向肝脏的主动摄取、生物转化生成代谢物以及药物和代谢物向胆汁的分泌。目前的体外模型,如短期悬浮的冷冻保存原代肝细胞或肝细胞共培养系统,可用于测定药物的固有清除率。然而,这些模型存在局限性,比如无法复制肝脏的代谢和转运表型(原代人肝细胞在培养中会迅速退化)、细胞与培养基的比例欠佳从而影响代谢和转运过程的可测量性,以及评估胆汁分泌的能力有限。肝细胞系表达的药物代谢酶和转运蛋白水平较低,限制了其预测人体药代动力学的能力。为解决这一问题,已开发出一种源自 TSC 的肝类器官系统,该系统表达广泛的 I 相药物代谢酶(如对药物进行化学修饰的细胞色素 P450 酶 CYP3A4 和 CYP2D6)、II 相酶(如将这些代谢物结合以促进其排泄的 UDP-葡糖醛酸转移酶和磺基转移酶)以及药物转运蛋白(包括阴离子转运蛋白 OATP1B3、ATP 依赖性转运酶 ABCB1(也称为 MDR1)和 MRP3)。该系统与微流控芯片集成,已被用于研究咪MI达DA唑CUO仑LUN的代谢和生物利用度,以及香XIANG豆DU素和二甲双胍在结合了肠和肾类器官的多器官平台中的排泄情况。此外,肝内胆管细胞类器官(ICOs)已被用于评估对乙酰氨基酚、羟基咪MI达DA唑CUO仑LUN和 7-羟基香XIANG豆DU素葡萄糖醛酸酯的代谢产物形成。尽管 ICOs 成功模拟了代谢产物的生成,但其 CYP 酶的表达水平低于原代人肝细胞,这凸显了进一步优化以匹配原代组织功能的必要性。
用于药物代谢和转运的肠类器官
早期的概念验证研究已表明,肠道类器官系统有助于更好地理解和预测肠道吸收及代谢情况。地塞米松、β-萘黄酮以及组成型雄烷受体激动剂 TCPOBOP 能够成功诱导源自 TSC 的肠道和肝脏类器官中 CYP 酶的活性,从而为药物代谢研究提供了可能。实际上,源自小鼠的隐窝类器官已被用于研究肠道药物代谢酶(DMEs),结果显示前体药物 CPT-11 能够转化为其有毒代谢物 SN-38。人十二指肠类器官被用于研究肽类药物的转运,证明了头孢羟氨苄、β-内酰胺类抗生素和环六肽的吸收。此外,基于 Transwell 的二维单层系统有助于双向(顶面/底面)运输研究(图 3a)。如上所述,这种二维设置始于 三维类器官被打开并置于二维基质上。向三维类器官上皮细胞的顶侧递送化合物需要向类器官腔内注射,而二维 Transwell 装置则可方便地接触到上皮结构的顶侧和基侧(图 3a)。因此,富含肠上皮细胞的极化人十二指肠类器官单层培养成功区分了高通透性和低通透性化合物,显示出包括 MDR1 和 BCRP 在内的主要外排转运蛋白的功能活性。此外,三维十二指肠和结肠类器官表现出对 I 相和 II 相药物代谢酶的代谢活性,且各段的差异与已知的药物代谢酶表达谱一致。为了直接接触顶侧表面,已生成了上皮极性反转的 。
采用类器官进行药物吸收、分布、代谢和排泄(ADME)研究
类器官在吸收、分布、代谢和排泄(ADME)领域的应用仍有限。关键挑战包括肝脏和肾脏类器官分化相对不成熟。此外,尽管动物体内药代动力学研究存在可转化性方面的限制,但其相对简便性往往超过了基于类器官平台预测的潜在优势。评估药物的 ADME 参数需要一个具有体内酶活性代表性、能模拟人体生理屏障功能且拥有足够组织量(数百万细胞)以催化药物生物转化的平台。尽管如此,类器官开始被用于解决与 ADME 相关的问题。尽管存在技术挑战,但类器官在满足 ADME 测试需求以及解决跨模式药物代谢预测的关键行业难题方面展现出前景。对于小分子而言,其主要优势在于能够模拟相关的转运、屏障功能和生理代谢活动。近期在具有功能性肝胆结构的肝类器官GUAN方面的进展有助于解决评估药物胆汁清除率方面的关键空白,而肾脏类器官开发方面的进展则有可能用于增强药物肾排泄的临床前评估。类器官能够真实地复制靶组织表达的能力对于大分子结合评估、靶点评估以及靶点介导的药物处置特别有吸引力。流体连接的类器官组织与血管类器官的组合有望通过实现重复采样和对药物代谢及向靶组织输送的精确评估来应对药代动力学和组织分布方面的挑战。
当前挑战的潜在解决方案
如上所述,类器官技术在药物开发中的广泛应用仍面临诸多障碍。其中一个障碍在于,尽管类器官比细胞系复杂得多,但它们仍是一种简化的模型,缺乏真实组织中的关键成分。大多数类器官没有血管,这限制了营养物质和氧气的输送,从而影响其生长、成熟和功能,尤其是在较大的类器官中。由于大多数药物是通过静脉注射给药的,类器官模型中缺乏血管化给药物的准确评估带来了挑战。类器官培养通常不包含免疫细胞,因此对免疫反应、炎症或免疫治疗相互作用的分析颇具难度。其他复杂的组织成分,如细胞外基质、基质细胞和神经元在类器官中也不存在,这影响了其功能和疾病建模能力。类器官无法模拟系统性相互作用,如激素信号传导或多器官间的相互作用。原生组织会受到生物力学力的作用,如切应力、拉伸和压力,这些在类器官培养中很难重现。另一个主要障碍是类器官培养的变异性,这会导致难以实现可重复性:不同实验室之间的培养方案存在差异,例如细胞来源、培养基成分和生长条件的不同,会导致类器官发育的不一致;来自不同患者捐赠者的细胞遗传多样性会导致不同批次类器官之间的差异;实现统一和可控的分化或功能仍然具有挑战性,这会导致类器官批次内部和批次之间的异质性;数据分析通常需要复杂的定制分析工具,这也增加了研究过程和结论的复杂性。这些局限性反过来又使类器官难以作为高通量筛选和大规模药物测试的标准化模型。同样,药物开发的可扩展性仍是一个挑战。要克服这些挑战,需要在培养方案方面取得进展,将微流控技术整合进来,并提高模型的复杂性,这些举措共同作用将使类器官充分发挥其作为个性化医疗和药物研发可靠工具的潜力。
基于类器官的药物筛选常规流程包括将类器官嵌入基质中,并将其接种到多孔板中,然后在上面添加培养基。自动化机器人技术和液体处理系统能够简化这一过程(图 4a)。这种方法已被用于源自乳腺癌和结直肠癌(CRC)的 PDTO 药物筛选。然而,该方法无法精确控制接种类器官的数量和空间分布,从而限制了高通量筛选(HTS)实验的可重复性。
生物工程微流控装置能够快速生成大量嵌入小体积细胞外基质(如基质胶)中的类器官。基质胶是从恩格尔布雷思-霍尔姆-斯瓦姆(Engelbreth–Holm–Swarm)小鼠肉瘤中提取的可溶性基底膜,富含细胞外基质蛋白(层粘连蛋白 111、Ⅳ型胶原和纤连蛋白),能支持极性和存活。这些装置将类器官播种在多孔板、微孔/微阵列或微柱芯片中(图 4a–d),能够精确控制类器官的形状、大小和细胞数量,从而极大地提高了均一性和可重复性(图 4b)。这类系统非常适合高通量筛选,因为其检测方法需要简单且可靠。理想情况下,生成的类器官应位于均匀的水平和垂直平面上,以便于基于成像的表型分析。例如,嵌入多孔板中的微工程水凝胶薄膜能够同时在相同的焦平面上生成数千个均匀的类器官,这些类器官被固定在微腔阵列中,从而能够对数千个单独的结直肠癌类器官进行实时自动成像,以评估抗癌药物的效果。利用微流控技术进行高通量的基质胶包埋类器官液滴打印,既能确保类器官间的同质性,又能保留组织异质性,从而能够准确预测药物反应,与患者的实际治疗效果相吻合。这种小液滴的格式——因其较大的表面积与体积比——还能实现高效的病毒感染和 T 细胞渗透,已被应用于 SARS-CoV-2 药物测试和快速嵌合抗原受体(CAR)-T 细胞效力检测。微孔阵列(图 4c)已被用于分析肺癌类器官,能在一周内预测药物反应;而 384 微柱板中培养的 3D 神经干细胞(图 4d)则可用于大规模化学文库的神经毒性筛选。
这些 3D 高通量平台通常使用生物相容性涂层基质,如聚二甲基硅氧烷、聚甲基丙烯酸甲酯、水凝胶或基质胶,以维持类器官的 3D 结构并支持细胞生长。对于某些类器官类型,例如脑类器官和肝组装体,可采用无基质悬浮培养,使用带有转子装置的超低附着板。这些悬浮培养也可集成到微流控系统中,以生成用于高通量筛选试验的大小可控且均匀的类器官。
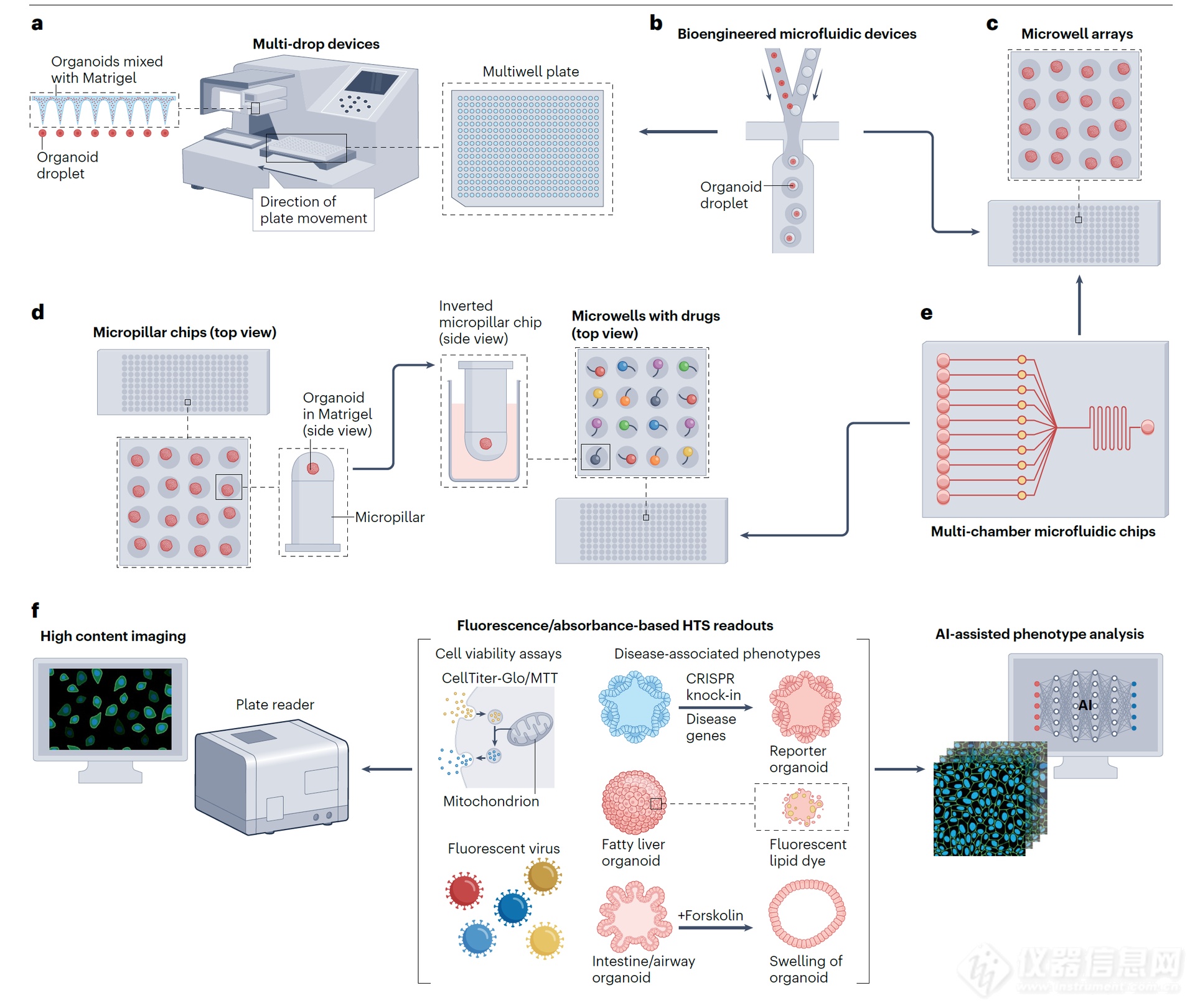
图 4 | 自动化高通量药物筛选策略。a,一种传统方法,使用多滴装置将类器官 - 基质胶混合物自动接种到多孔板中。b,生物工程微流控装置能够快速生成大量重复的类器官液滴,对其形状、大小和细胞数量进行精确控制。c,d,这些类器官液滴随后可被引入多孔板(图 a)、微孔阵列(图 c)或微柱芯片(图 d)中进行进一步的药物评估。不同颜色表示微孔中的不同药物。e,多腔室微流控芯片可用于高通量筛选(HTS),只需将类器官细胞直接接种到腔室中即可,或者它也可以形态学终点正逐渐被采用以提高类器官研究的通量和标准化。类器官可以固定在福尔马林中并包埋在石蜡中(FFPE),或者新鲜冷冻并包埋在切割温度化合物或明胶中。组织微阵列可以将一整块 96 孔板的类器官无缝整合到现有的高通量筛选(HTS)设置中(例如,微孔或微柱芯片),以促进药物递送。f,基于荧光或吸光度读数的自动化成像和数据处理,借助人工智能(AI)驱动的算法。高通量筛选读数的示例包括细胞活力测定,如 CellTiter-Glo 或 MTT,用于感染性疾病药物筛选的荧光病原体,以及基于疾病相关表型的评估,例如疾病标志物的表达、疾病酶的活性、用于监测代谢疾病中代谢物动态的荧光染料以及与疾病相关的形态变化。嵌入 FFPE 块中,为人工智能(AI)支持的定量图像分析提供了工具,这一技术源自新兴的数字病理学领域。这使得分子病理学方法的应用成为可能,包括免疫组织化学、多重免疫荧光、空间转录组学和电子显微镜技术。
监管机构的挑战与机遇
尽管类器官具有诸多优势,但在其能够顺利融入药物研发流程之前,监管机构的认可仍是一大障碍。解决这些难题将有助于加强药物安全性评估,促进更有效疗法的开发,并减少对动物实验的依赖。
类器官在药物安全性测试中的应用
在药物安全性测试中,类器官应用的主要挑战在于模型鉴定、可重复性、临床转化、成本效益优化以及监管机构的认可。为了支持人体临床试验,临床前测试通常结合体内和体外模型,以ZUI大限度地提高临床预测性,同时减少动物使用。当需要功能性和生理相关性终点时,类器官可以补充传统的二维细胞培养检测,特别是在解决机制问题方面,但目前监管申报更倾向于使用复杂度较低、通量较高且成本较低的体外工具。要实现更广泛的应用,必须证明其相对于传统方法具有明显优势,例如在特定使用情境下具有更强的预测能力。此外,扩大在不同使用情境和治疗方式下的鉴定工作,对于增强人们对类器官相对于更简单的传统体外方法的预测价值的信心至关重要。重要的是,尽管类器官在预测毒性方面作为转化模型展现出前景,但这里介绍的大多数研究仍属于临床前的概念验证工作,与体内和患者数据的验证仍有限。要将类器官确立为转化标准,还需要进行更多的正向和反向转化研究。
类器官在临床前药物开发中的应用通常分为两类:内部决策(例如筛选和机制研究)以及纳入监管申报材料。制药公司已在选定的使用场景中将类器官用于探索性和机制性研究,但这些研究很少在决定临床试验安全性方面起关键作用。
类器官的复杂性也带来了实际的障碍。其构建和维护需要大量的时间、资源和技术专长,通常还需要成像和数据分析流程。对于资源有限或使用场景零星的组织来说,在内部维持这种专长往往是不切实际的。将工作外包给拥有大量基于类器官项目的专业合同研究组织,这些组织具备稳固的商业模式,是一种可行的替代方案。此外,努力实现标准化和自动化流程以及简化工作流程对于充分发挥类器官的更广泛效用以及确保其融入药物开发流程至关重要。
用于药物开发的类器官监管框架
在首SHOU次人体临床试验前进行非临床研究的目标是评估产品的药理活性,并确保在 I 期临床试验中健康志愿者或患者的安全。对于人类药物开发,美国食品(FDA)的规定并未明确要求用于支持临床试验的药物在人体中具有合理安全性的非临床研究的类型或设计(无论是体内、体外还是计算机模拟研究)。尽管动物毒性研究对于识别潜
在的人类风险至关重要,但寻找减少动物使用并开发有效替代方法的途径是一项重要工作。在监管背景下,对于诸如类器官等更具人类预测性的转化平台和技术的需求巨大,这些平台和技术被定义为新方法学(NAMs)29,262。2022 年,美国国会通过了《FDA 现代化法案 2.0》(参见文献 30),随后又通过了《法案 3.0》(参见文献 31),明确了在药物开发中对动物试验的感知要求。这要求 FDA 建立一条途径,使相关实体能够申请批准特定使用情境下的非临床测试方法。为此,美国食品(FDA)启动了“替代方法计划",首先,扩大流程以确认替代方法可用于监管;其次,为外部利益相关者开发替代方法提供明确的指导方针;第三,通过应用研究信息空白,以推进新政策和指导方针的制定。最近,FDA 宣布计划在实验室环境中用一系列方法取代单克隆抗体疗法和其他药物开发中的动物试验,包括基于人工智能的毒性计算模型、细胞系和类器官毒性测试。
然而,要将类器官成功应用于临床前测试流程,就需要对其进行恰当的表征、验证和鉴定,以向终端用户以及卫生主管部门证明其适用于特定用途或使用情境(见方框 3)。经济合作与发展组织(OECD)对验证原则进行了详尽阐述,为如何针对特定使用情境评估类器官提供了有用的指导。这种评估对于监管环境中使用的方法来说是标准流程。目前,跨行业联盟和卫生主管部门正在共同努力,以实现对包括类器官在内的非动物模型的监管认可,重点在于制定标准和培训相关方法。理想情况下,由生物工程师、生物学家、毒理学家和病理学家等不同领域的科学家团队共同开发类器官模型,并对其使用情境进行综合评估。
监管展望
目前,只有少数基于细胞的测试方法被经合组织测试指南所描述。大多数毒性测试仍属于非指南方法。最近,美国食品(FDA)和欧洲药品管理局(EMA)都提出了推进非动物方法(NAMs)监管认可的路线图。
方框3 | 监管指南
在经济合作与发展组织(OECD)层面,有三份与体外方法开发和使用相关的指导文件:《Guidance Document on Good In Vitro Method Practices体外方法实践指导文件》(GIVIMP)、《Guidance Document for Describing Non-Guideline In Vitro Test Methods描述非指南性体外测试方法指导文件》(GD211)以及《Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessments新的&更新的危害评估测试方法的验证和国际认可指导文件》(GD34)。GD34 和 GD211 支持对类器官进行详尽的描述、表征和验证,以增强其可信度。表征可以包括对类器官的生物学相关性和科学有效性的评估,而验证则指的是为特定使用情境确立特定检测方法的可靠性和相关性的过程。
例如,在药物开发方面,欧洲药品管理局(EMA)的自愿提交数据程序,也称为“安全港"方法,旨在允许生成、汇编和审查数据,以帮助确定新替代方法(NAM)的使用范围。此外,EMA 评估特定使用范围内给定 NAM 的监管接受程度及其局限性。这一过程旨在增强对 NAM 的信心,并可能支持基于定义的使用范围起草资格标准,从而指导模型开KAI发者如何为监管应用对新型模型进行资格认定。美国食品(FDA)的路线图侧重于在数年内逐步用替代方法取代单克隆抗体和其他药物的动物试验。
因此,在监管申报中逐步将类器官纳入非动物模型,以替代、减少和优化动物模型,具有潜力。然而,这不应损害药品评估所要求的既定标准。至关重要的是要保持谨慎的平衡——接纳包括类器官在内的这些创新方法,同时坚守欧洲药品监管网络的严格标准。
结论
在药物开发中使用类器官为临床前研究提供了向更准确、更贴近患者实际情况的模型迈进的巨大飞跃。正如所描述的那样,类器官为重现人体组织的复杂性提供了一个平台,相较于传统的二维细胞培养和动物模型,它能提供更符合生理条件的环境。然而,尽管该领域已取得重要进展,但仍面临诸多挑战。类器官培养的可扩展性和可重复性,尤其是在高通量筛选(HTS)的背景下,仍需进一步改进。这将需要持续开发和验证标准化、自动化的类器官平台,并建立明确的监管框架以促进行业采用。此外,提高类器官对人类治疗反应的预测能力——尤其是在癌症、神经退行性疾病、慢性炎症和代谢疾病等复杂疾病方面——还需要在血管化、免疫系统整合和多器官建模方面进行创新,同时结合单细胞组学、高速图像采集和人工智能支持的数据分析等前沿分析技术。随着技术的成熟,我们预计基于类器官的平台将成为药物研发流程中的一部分,弥合基础科学与临床结果之间的差距。类器官可能会改变我们理解和治疗疾病的方式,其在药物开发中的未来前景广阔。

