PROUCTS LIST
NEWS
蛋白稳定性分析仪PSA-16助力心梗的机制研究和药物开发
蛋白稳定性分析仪PSA-16助力河南大学抗体药物开发技术国家地方联合工程实验室的科研工作者于 2025年3月在《International Journal of Biological Macromolecules》期刊上发表“Attenuation of cardiac ischemia/reperfusion injury via the decoy receptor DcR2 by targeting the PLAD domain of the death receptor DR5”论文。
本研究旨在确定 DcR2 的作用靶点,并探究 DcR2 在小鼠心肌 I/R 损伤中的心肌保护机制。结果表明,hDcR2-Fc 融合蛋白对心肌缺血/再灌注损伤具有显著的保护作用。DcR2 通过其 PLAD 结构域与 DR5 形成异源复合物,该结构域不具有完整的死亡结构域,因而无法向下游传递信号。此外,复合物的形成掩盖了与配体 TRAIL 相互作用的位点,从而减轻了缺血/再灌注损伤后的心肌细胞死亡。因此,本研究揭示了 DcR2 的 PLAD 结构域在抑制细胞凋亡中起关键作用,为新型药物的研发提供了潜在靶点。
Lijie Zhang, Xinyuan Zhang, Ziting Li, Tingting Mo, Wanting Feng, JingLun Zhang, Dan Zhao, Ying Wang, Yinxiang Wei, Yaohui Wang
Joint National Laboratory for Antibody Drug Engineering, the First Affiliated Hospital, Henan University, Kaifeng, China
School of Medicine, Henan University, Kaifeng, China
Joint National Laboratory for Antibody Drug Engineering, Henan University, Kaifeng, China
Zhou, D. et al.
蛋白质的热稳定性是指蛋白质多肽链在温度影响下的形变能力,主要体现在温度改变时多肽链的化学特性和空间构象的变化,变化越小热稳定性越高。蛋白质的热稳定性受到不同温度、pH值、离子强度等外界因素的影响,在生物技术、药物研发以及食品工业等领域,具有重要意义。
蛋白质变性温度是生物学家们研究蛋白质的热稳定性的一个重要的概念,是指蛋白质在特定温度条件下受到热力作用时,其结构发生变化的温度点,一般温度较高时,蛋白质从稳定的三维结构变化成松散的无序结构。蛋白质的热稳定性一般使用热变性中点温度(Tm)来表示,即蛋白质解折叠50% 时的温度。
01 前言
缺血缺氧导致的心肌细胞死亡是心肌损伤的主要原因。DcR2 是 TRAIL 的诱骗受体,DcR2 在心肌缺血/再灌注(I/R)损伤中的作用尚不清楚。近期研究表明,DcR2 不仅作为受体与 TRAIL 结合,还能作为 DR5 的配体在体外阻断 TRAIL 诱导的细胞凋亡,但 DcR2 在体内对 TRAIL 或 DR5 的亲和力偏好尚不清楚。之前的研究发现,hDcR2-Fc 融合蛋白在小鼠心肌 I/R 损伤模型中发挥心脏保护作用,通过减少细胞凋亡来实现。亲和力测定表明,DcR2 对 DR5 的亲和力大于对 TRAIL 的亲和力,且 DcR2 更倾向于与 DR5 结合。机制研究表明,PLAD 的缺失消除了 hDcR2-Fc 对 I/R 引起的心肌损伤的保护作用。DcR2 通过类似的 PLAD 结构域与 DR5 形成异源复合物。综上所述,本研究揭示了 DcR2 可通过 PLAD 结构域靶向 DR5 形成异源复合物,阻断细胞凋亡,从而改善心肌 I/R 损伤,为心肌 I/R 损伤的治疗提供了新的预防策略。
02 摘要
急性心肌梗死(AMI)是一种严重威胁人类生命健康的疾病,全球范围内 AMI 的死亡率仍然很高。由缺血缺氧引起的心肌细胞死亡是一种不可逆的损伤。经皮冠状动脉介入治疗(PCI)能有效降低急性心肌梗死患者的死亡率,但存在两大难题,即治疗的黄金时间短以及缺血/再灌注(I/R)损伤。此外,长期心力衰竭的发生率也很高。为了缩小心肌梗死的范围,延长心肌细胞死亡的“窗口期”,改善患者的长期预后,需要研发能够减少或逆转心脏损伤的新疗法。
心肌梗死通常伴有多种病理变化,其中最严重的是心肌细胞凋亡。然而,临床上尚无治疗心肌细胞凋亡的有效策略。因此,寻找预防心肌细胞凋亡的关键靶点可能为心肌梗死的预防和治疗提供新的策略。肿瘤坏死因子(TNF)相关凋亡诱导配体(TRAIL),也称为Apo2配体,属于TNF配体超家族。迄今为止,人类已鉴定出五种TRAIL受体。DR4(TRAIL-R1)和DR5(TRAIL-R2)被称为死亡受体(DRs),它们具有完整的死亡结构域(DD),能够传递由TRAIL调节的死亡信号。DRs介导相关下游信号通路的激活,从而导致细胞凋亡,其中DR5是主要的死亡受体。作者之前的研究证实sDR5-Fc融合蛋白可以特异性阻断TRAIL-DR5通路,从而改善猴、猪、大鼠心肌梗死后的心功能。
03 结果
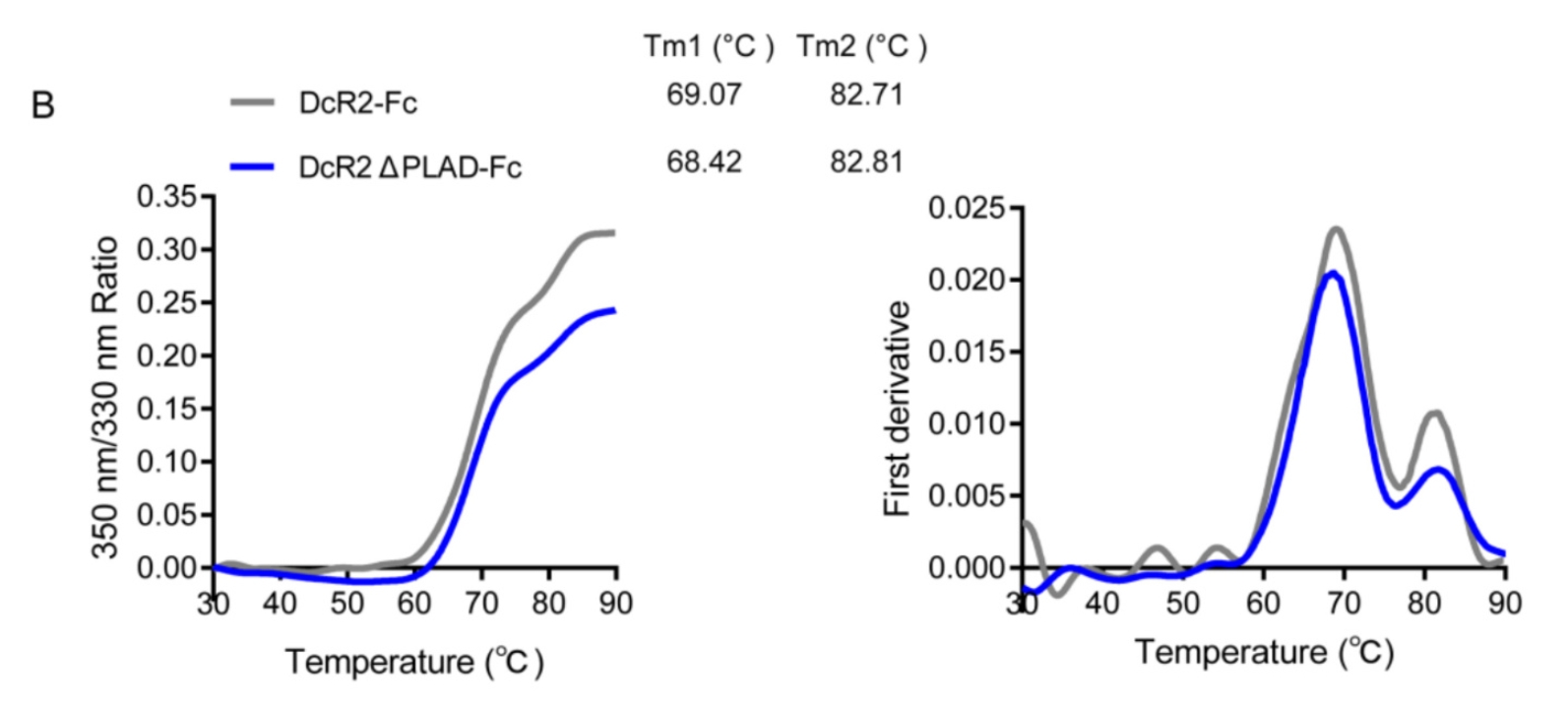
为了确定 PLAD 是否介导 DcR2 与 DR5 的结合,作者制备了 PLAD 结构域缺失的 DcR2ΔPLAD-Fc 融合蛋白。PLAD 结构域的去除并未影响DcR2 的二级结构,但其熔解温度(Tm)略有下降,表明其稳定性有所减弱。随后测定 DcR2APLAD-Fc 与 TRAIL 的亲和力为 4.724×10-7 M,略低于野生型。细胞凋亡阻断实验的结果表明,去除 PLAD 结构域后 DcR2 无法阻断细胞凋亡,这证实了 PLAD 结构域的重要性。
作者进一步借助蛋白稳定性分析仪PSA-16,通过差示扫描荧光法(Differential scanning fluorimetry,DSF)原理进行NiV G-ferritin和NiV sG的热稳定性分析,结果表明,NiV G-ferritin和NiV sG表现出相似的热稳定性,Tm为~65°C,表明NiV G和ferritin的融合对其结构稳定性没有显著影响。
由于NiV G-ferritin可以诱导强大的体液免疫反应,研究者还从NiV G-ferritin免疫小鼠体内筛选、制备了一批单克隆抗体(monoclonal antibody,mAb)。在分离的27种mAbs中,25种mAbs可以有效抑制水疱性口炎病毒(VSV)为骨架的NiV假病毒的感染,其抑制50%的NiV假病毒感染所需要的浓度(IC50)低于10 ng/mL。表位竞争分析发现,筛选得到的27个mAbs可以识别NiV G蛋白上4个不同的抗原表位,包括2个新的此前未被报道的表位。最后,研究者在尼帕病毒感染的致死模型(叙利亚金黄仓鼠)上评估了NiV G-ferritin诱导的免疫反应和保护效果。研究发现给与仓鼠2针或者3针的NiV G-ferritin后,仓鼠体内均产生了高中和活性的血清,且接种2次或者3次均能够帮助仓鼠100%的抵抗致死剂量NiV的攻击。研究者进一步检测了3针疫苗接种仓鼠体内的病毒RNA含量,结果发现,仓鼠的肺脏、脑和脾脏中均未检测到病毒RNA,表明三剂NiV G-ferritin抑制了病毒在仓鼠肺部、大脑和脾脏的复制。
04 方法
差示扫描荧光法
使用PSA-16仪器(北京佰司特科技有限责任公司)通过差示扫描荧光法(Differential scanning fluorimetry,DSF)测定靶蛋白的热稳定性。将样品稀释至0.5mg/mL,并将20μL稀释后的样品装入石英玻璃管中。使用23至97°C的线性温度扫描,以1°C/min的加热速度实时动态测量靶蛋白在280nm紫外激发下的330nm和350nm的荧光强度(F)。根据F350nm/F330nm曲线的斜率计算热变性中点温度(thermal transition midpoint,Tm)。每个样品平行测量四次。
多角度光耦合的粒径排除色谱法散射(SEC-MALS)
每个样品100 μL体积(NiV g -铁蛋白0.5mg/mL, 2mg/ mL) mL (NiV sG)注入WTC-030S5色谱柱(Wyatt Technology, Santa Barbara, CA, USA),等温运行0.5 mL/min 以20mMTris-HClpH8.0和150mmnacl为移动端 阶段。一个MALS检测器(DAWN®)和一个折射率检测器(RI) (Wyatt Technology, Santa Barbara, CA, USA)串联到 SEC系统上的紫外线探测器。牛血清白蛋白(BSA 采用Scientific)对静态光散射探测器进行归一化处理。光 散射,差折射率(dRI)测量,和分子 采用ASTRA软件(6.1.2.84)(Wyatt Technology)。
酶联免疫吸附试验(ELISA)
采用ELISA法检测NiV g -铁蛋白的抗原性。简单地说,96 - 用3 μg/mL的NiV在4℃下包被ELISA板(康宁)过夜 sG或NiV g -铁蛋白涂层缓冲液(0.1Mcarbonate, pH9.6)。后四个 用PBS-T(pbs含0.05%Tween 20)冲洗1次后,所有的孔都被堵塞 用50 μL阻断缓冲液(PBS-T中1% BSA)在37℃下作用2 h。后 阻断,NiV G单抗HENV-32, HENV-26, nAH1.3,抗狂犬病 病毒单抗RVC20(阴性对照)从5 μg/mL开始依次稀释 加入板中,37℃孵育2 h PBS-T洗涤4次,然后加入HRP结合的山羊抗人抗体 IgG(1∶20000稀释,ab克隆,AS002)在37℃下保存1 h。盘子 用50 μL/孔的单组份TMB显色剂冲洗染色 溶液(NCMBiotech)在37°C下保存10-30分钟。底物反应 加入50 μL/孔的1M HCl,吸光度为 在450nm处测量(OD450)。对于血清结合滴度检测,作者通过 NiV-M、NiV-B、NiV-B的G头蛋白 将HeV、LayV和MojV包被在ELISA板上,HRP偶联 采用山羊抗小鼠IgG(1∶8000稀释,ab克隆,AS003)。
。。。。。。
05 总结
综上,本研究成功设计了一种以NiV G蛋白头部域为抗原靶标,以ferritin为展示平台的新型纳米颗粒候选疫苗,并分离了一批具有潜在治疗效果的单克隆抗体。研究为深入理解尼帕病毒G蛋白的免疫原性提供了新的见解,NiV G-ferritin有望进一步开发为亨尼帕病毒的广谱候选疫苗,为全球公共卫生安全提供新的防护策略。
武汉大学病毒学国家重点实验室赵海艳研究员和中国科学院武汉病毒研究所邓增钦研究员为该论文的共同通讯作者。武汉大学生命科学学院博士研究生周丹、已毕业的硕士研究生程娆以及中国科学院武汉病毒研究所高级实验师姚艳丰博士为论文的共同第一作者。
该研究得到了国家重点研发计划项目、湖北省卫生健康委青年人才项目和中国科学院院级人才项目的资助,并获得武汉国家生物安全实验室和武汉病毒学国家重点实验室的支持。
原文链接:https://www.nature.com/articles/s41541-024-00954-5
作者借助北京佰司特科技有限责任公司自主研发的蛋白稳定性分析仪PSA-16,通过差示扫描荧光法(Differential scanning fluorimetry,DSF)原理进行NiV G-ferritin和NiV sG的热稳定性分析,结果表明,NiV G-ferritin和NiV sG表现出相似的热稳定性,Tm为~65°C,表明NiV G和ferritin的融合对其结构稳定性没有显著影响。







